|
Plasmid ve Episomlar Prof. Dr. Mustafa Arda
Ankara Üniversitesi
Veteriner Fakültesi 01. Giriş 01.Giriş Bazı prokaryotik (bakteri) ve ökaryotik organizmalarda (maya, mantar, bitki), kendi büyük kromozomları (genomik DNA) yanı sıra, bundan ayrı,olarak çok daha küçük, DNA karakterinde, çift iplikçikli diğer genetik elementler bulunmaktadır. Bunlar arasında plasmidler de yer almaktadır. Ancak, bu genel tanım içine, bakteriyofajlar, kromozomla birleşik olan profajlar, transpozonlar, İS-elementleri ökaryotiklerde de mitokondriumlar da girmektedir. Burada, sadece, bakterilerdeki plasmid ve episomlardan bahsedilecektir.02. Plasmidlerin Genel
Karakterleri Plasmidler
çift iplikçikli otonom DNA molekülleridirler. Şimdiye dek prokaryotik ve
ökaryotiklerde RNA (ribonukleik asit) özelliği taşıyan plasmidlerin varlığı
bildirilmemiştir. Bakterilerdeki plasmidler genellikle, sirküler, sarmal ve çift
iplikçikli bir yapıda olup MA. 1-600 x 106
dalton (1-600 mega dalton, Md) arasında değişmektedir. E. coli 'de bulunan plasmidler, genomik DNA'nın (2.7 x
109 bp, yaklaşık 1.1-1.4 mm uzunlukta) %0.04-%8'i
kadardır. Büyük plasmidlere (MA > 50 Md) daha ziyade, Gram negatif
mikroorganizmalarda (Pseudomonas, Agrobacterium, vs) rastlanılmaktadır. Streptomyces rochei 'de iki küçük ve lineer morfolojide
plasmidin varlığı bildirilmiştir. B.
burgdorferi
'de 4-9
adet lineer ve sirküler plasmidlerin varlığı bildirilmiştir. Lineer olanlar 43, 38 ve
45 kb ve sirküler olanda 26 kb uygunlukta olup bunlar sıra ile Outer
surface protein (Osp)'leri (OspA, B; Osp D; Osp E ve F ile OspC'yi kodlarlar. Ekstrakromozomal
materyaller, hücre sitoplazmasında serbest olarak bulunabilecekleri (plasmid) gibi bakterinin kromozomu ile de
birleşebilirler. Böyle plasmidlere episom
adı verilmektedir. Kointegrasyon,
plasmidle genomik DNA arasında oluşabileceği gibi, plasmidle plasmid arasında da
meydana gelebilir. Ancak, pratikte, episom ile plasmid eş anlamlı olarak ve daha ziyade
plasmid adı altında tanımlanmaktadır. Bazı plasmidler de Col E1 gibi, negatif süpersarmal (süperheliks) bir yapı özelliğine sahiptir ve bu
kolisinin E. coli 'de 19-20
süpersarmal bulunmaktadır. Değişik
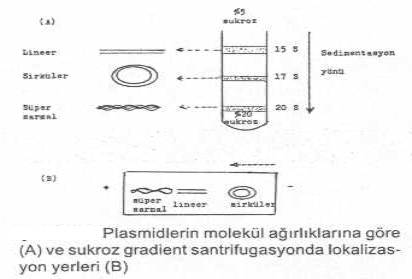
morfolojilere sahip plasmidlerin (lineer, sirküler,
süpersarmal) gerek agarose gel
elektroforezisdeki lokalizasyonları ve gerekse sentrifugasyondaki sedimentasyon
katsayıları (S20 W) arasında
farklar vardır. Bunlar, sukroz densite gradient
(%5-20) sentrifugasyonda, santrifüj tüpünde sukrozun
değişik yoğunluğuna sahip yerlerinde toplanırlar. Örn, Col. E1'in lineer formu (15 S) üstte (%5
sukroz), sirküler formu (17 S) ortada ve süpersarmal formu da (23 S) altta (%20 sukroz)
lokalize olur. Elektroforezisde ise, süpersarmal form karşı uçta, lineer form ortada
ve sirküler formlar ise başlangıç yerine yakın kısımlarda yerleşirler.
Plasmidler
bazı özel genetik bilgileri taşırlar (şifreler halinde). Gerek plasmidlerin kendileri
ve gerekse kodladıkları spesifik informasyonların konak bakteri için çok lüzumlu
veya hayati önemi yoktur. Bunlar olmadan da bakteriler normal yaşamlarını
sürdürürler. Çünkü, plasmidler bakterilere sonradan transfer olmuşlardır ve özel
koşullar altında da bakteriden ayrılabilirler. Ancak, bunlar bakterinin genomunda
bulunmayan (veya bazen de bulunabilen) bazı özel karakterleri kazandırırlar ve
avantajlar sağlarlar: Örn, antibiyotiklere, metallere, ilaçlara dirençlilik, toksin
formasyonları, pilus oluşumu, virulens faktörleri, fermentasyon özellikleri, nitrojen
fikzasyonunu, vs) bunlardan sadece birkaç tanesidir. Böyle özellikler kazandıran
plasmidler bakterilerden ayrılırsa veya çıkarılırsa (plasmid eliminasyonu, plasmid eksklusyonu, curing),
bakteriler kazandıkları bu avantajları kaybederler ve bu yönlerden negatif hale
gelirler. Örn, C. tetani 'de
toksin formasyonu bir plasmid tarafından kodlanır. Bu plasmidin çıkması etkeni nonpatojenik (nontoksijenik) hale getirir. B.
anthracis için de durum bir benzeridir. Bakterilerde
doğal olarak bulunan plasmidlerden ziyade, in vitro koşullarda ve amaca uygun olarak
kendilerine istenilen özel markerler katılarak hazırlanan suni plasmidler (pBR322, pUC8/9 ve diğerleri) rekombinant DNA teknolojisinde, genlerin
klonlanmasında aracı molekül (vektör) olarak fazlaca kullanılmaktadırlar. Doğal plasmidlerin stabilitesine tam
güvenilemediği gibi özel markerler yönünden de hem yetersiz ve hem de istenilenleri
taşımadıkları için, klonlamada tercih edilmemektedirler. Büyük
plasmidler bir bakteride, genellikle, 1-4 kopya halinde bulunmalarına karşın, küçük
plasmidlerin kopya sayısı 20-50'ye ulaşmaktadır (multikopya plasmidler). Ayrıca, plasmidlerin
bakteri içindeki kopya sayısını bazı özel teknikler kullanmak suretiyle artırmak
mümkündür. Küçük plasmidlerin hemen ekserisi, kromozomla da birleşmediğinden veya
sitoplasmada yeterince bulunduklarından, hücrelerden çıkarılmaları oldukça kolay
olmaktadır. Bu nedenle gen aktarmalarında da genellikle küçük veya orta boy suni
plasmidlerden daha fazla yarar sağlanmaktadır. Hücre içinde kopya sayısının fazla
olması, ekspresyon yönünden de avantaj olarak kabul edilmektedir. Molekül
ağırlıkları > 50 Md'den fazla olan büyük
plasmidler, hem kendilerini ve hem de taşıdıkları informasyonları ve ayrıca,
bazen de konakçı kromozomundan bir segmenti (veya geni), aynı türden veya çok yakın
cinse ait türlere transfer etme yeteneğine (bu amaç için gerekli bilgilere veya
sekanslara) sahiptirler (konjugatif plasmidler,
transmissible plasmidler). Buna karşın, küçük plasmidler (MA < 20 Md) ise, ya aynı
bakterideki büyük plasmidlerin yardımı ile veya konakçının genomu ile birleşerek
bakteri bölünmesi sırasında kardeş hücrelere transfer edilirler. Bunlardan ayrı
olarak, genel transdüksiyonla da küçük plasmidler transfer olabilirler. Bazı
durumlarda da, kimyasal ve fiziksel yöntemler kullanarak plasmidlerin bakteriden
çıkması kolaylaştırılır ve serbest hale getirilebilirler. Böylece, daha kolay
transferleri sağlanır. Küçük plasmidler, kendilerini transfer için gerekli bilgileri
kodlamadıklarından bağımsız olarak aktarılmaları mümkün değildir (nonkonjugatif plasmidler, nontransmissible plasmidler).
Konjugatif plasmidlerde bulunan seks pilusu formasyonunu kodlayan genler,
nonkonjugatiflerde bulunmamaktadır. Bu pilusun gen transferinde çok önemli fonksiyonu
vardır. Konakçı
içinde bağımsız replike olabilen plasmidler, sitoplasmik membranda bulunan özel
bölgeyi (mesosom), genomla ortaklaşa
kullanırlar. Çünkü, bakteri DNA'sının replikasyonuna mani olan mutasyonlar aynı
zamanda plasmid replikasyonunu da bloke ederler. Buna karşın, küçük plasmidler
bakteri kromozomu ile senkronize replike olmadıkları için böyle mutasyonlardan
etkilenmezler. Bunlar ancak, DNA pol I'de oluşan mutasyonlara duyarlıdırlar. Konjugasyon
aparatı (seks pilusu) bir çok plasmid
tarafından kodlanmaktadır. Örn, F-faktörü (fertilite faktörü), R-faktörü (rezistanslık faktörleri), Col
I ve Col V plasmidleri böyle
etkinliğe sahip olanlar arasındadır. Bu faktörlerin kodladıkları piluslar arasında
da morfolojik ve antijenik farklılıklar bulunmaktadır. Ayrıca, ayrı faj sistemlerini
de adsorbe ederler: Aktarılan plasmidler, alıcının sitoplasmasında ya bağımsız
olarak kalırlar veya kromozomla da birleşebilirler. Aynı
gruptan veya aynı karaktere sahip iki tür plasmid, bakteride bağlanma yerlerinin
replikasyon sırasında aynı olması nedeni ile, birinin çoğalması diğerinin
replikasyonuna mani olur ve buna bağlı olarak ta süper
infeksiyon meydana gelemez. Böyle plasmidler birbirleri ile uyuşamadıkları
için inkompatible olarak
nitelendirilirler. E. coli K12 de, F-faktörü için 8-10, R-faktörü için iki ve kolisin faktörleri için
de değişik sayıda bağlanma yerinin bulunduğu bildirilmiştir. Plasmidler,
aynı fajlar gibi, regulatör sistemlere sahiptirler ve bunlar yardımı ile kendi
replikasyonlarını ve diğer özel fonksiyonlarını düzenlerler ve
sınırlandırabilirler. Bu nedenle de plasmidlerin bir hücre içindeki kopya sayıları
genellikle ayarlanmıştır. Örn, E. coli
'de F- ve R-faktörleri için 1-2 ve proteuslarda ise 10 kopya bulunmaktadır. Bir
ekstrakromozomal element, bir bakteri de plasmid tarzında bulunduğu gibi, diğer bir
bakteride episom halinde olabilmektedir. Örn, F-lac plasmidi, P. mirabilis 'te sitoplasmada (plasmid) bulunur. Bu plasmid E. coli'ye transfer edildiğinde genoma
yerleşir (episom). Bir plasmid'in sitoplasmada veya konakçının nukleusuna integre
olmasında represör proteinlerin rolü
oldukça fazladır. Plasmidlere
enterobakterilerde (Escherichia, Salmonella,
Shigella, Klebsiella, Proteus vs. türlerinde) fazla sıklıkta rastlanılmaktadır.
Bu nedenle bu grup plasmidlere koliform plasmidler
adı da verilmektedir. Bu plasmidler, bu grupta bulunan cinslere ait türlere de transfer
edilebilirler. Gram
pozitif mikroorganizmalarda da plasmidlere tesadüf edilmiştir. Stafilokoklardaki (S. aureus) penicillinase (beta-lactamase) enzimini
kodlayan büyük plasmid buna örnek verilebilir. S. aureus 'ta değişik büyüklükte (küçük veya
büyük) plasmidlere rastlanılmıştır. Büyük olanlar genellikle tek kopya
halindedirler. Sirküler formda ve tek iplikçikli olan plasmidlerin replikasyonları
konakçının genomu ile senkronizedir. Penicillinase plasmidi bir R-plasmididir ve
bakteriye dirençlilik kazandırır. S. aureus 'ta bulunan küçük plasmidler (3 Md)
tetrasiklin ve kloramfenikola dirençlilikte fonksiyoneldir. Bu plasmidlerin
replikasyonları, genomdan bağımsızdır. Diğer bir deyimle hücre bölünmesine
bağımlı değildirler. Bu nedenle de bir hücrede çok sayıda kopyası (multikopya) bulunabilmektedir. S. aureus 'taki beta-lactamase ve kloramfenikol asetil
transferase enzim üretimi indüklenebilir bir karakter taşımaktadır. N.
gonorrhoeae
'de kriptik plasmid (2.4 Md) olarak tanımlanan
genetik elementlerin yapıları ve karakterleri tam olarak belirlenememiştir.
Gonokoklarda, beta-lactamase enzim sentezini kodlayan plasmidlerin 3.2-4.4 x 106 dalton oldukları belirtilmiştir. Beta-lactamase
plasmidi, genel transdüksiyonla başka stafilokoklara transfer edilebilir. Hücrede
genellikle bir kopya olarak bulunur. Molekül
ağırlıkları 100 Md'den büyük olan plasmidler genellikle 100 polipeptidlik bir
zincirin sentezini sağlayacak kadar genetik bilgilere sahiptirler. Plasmidlerin
replikasyonları, UV-ışınları ve akridin boyalarına karşı oldukça duyarlıdırlar.
Ayrıca, bu faktörler tarafından da bakteriler plasmidlerden kurtulabilirler (iyileşme). Eğer
bir hücrede, biri kendini bağımsız transfer edebilen (konjugatif) ve diğeri de bu yeteneğe sahip
olmayan (nonkonjugatif) iki plasmid
bulunursa, bunlardan transmissible olanı, diğerini de mobilize ederek aktarılmasını
sağlayabilir. Bu olgu, bu iki plasmid, konakçının genomu ile integre olduğunda daha
kolaylıkla gerçekleşebilir. Plasmidlerin
transfer olma durumları bunların özel pilus (seks
pilusu) oluşturma yeteneğine bağımlı olması yanı sıra, iki bakterinin
(alıcı ve verici) direkt teması da gen aktarılmasında etkili olmaktadır. Ancak, seks
pilusu yardımı ile gen aktarımı daha fazla sıklıkla gerçekleşebilmektedir.
Bakteriler arasında gen transferleri 10-5
-10-7 arasında ve ayrıca
türlerin birbirlerine olan genetik yakınlığına göre değişmektedir. Koliform
plasmidler, E. coli 'den Proteus
türlerine 10-5 oranında
aktarılmasına karşın, E. coli 'den
E. coli 'ye transfer çok daha
sıktır (10-1-10-3). F-plasmidi,
F+ hücre X F- hücre veya
Hfr X F- hücre birleşmelerinde,
alıcı hücrelere aktarılırken, alıcı bakteriye, plasmid ve/veya bakteri
kromozomundan başka herhangi bir sitoplasmik komponent geçmemektedir. Plasmidler
bazı yönleri ile de bakteriyofajlara benzerlik gösterirler. Fajların bazıları
bakterinin sitoplasmasında bulunur, burada replike olur fakat konakçısını lize etmez (P1 fajı gibi)
veya bir kısmı lize ederek parçalar (litik
infeksiyon). Bir kısım fajlar da konakçının DNA'sı ile birleşir (profaj). Bu durum, F faktörünün E. coli DNA'sına integre olmasına benzer (Hfr hücre). 03. Plasmidlerin Yapısı Plasmidler,
genellikle, konakçı bakteri içinde kendi bağımsız durumlarını koruyabilecek ve
devam ettirebilecek gerekli genetik informasyonlara sahip otonom ünitelerdir. Plasmidlerde bulunması
gerekli olan en önemli sekansların başında, replikasyonda fonksiyonu olan replikasyon orijini (RO)'ni kodlayan nukleotidlerdir. Aslında, RO'ya
sahip olan küçük veya büyük DNA sekansları bağımsız replikasyon özelliği
gösterebilirler (replikon). Replikasyon
orijini plasmidlerde genellikle tek olmasına karşın, bazılarında R6K plasmidinde 2-3
RO bulunabilmektedir. Küçük plasmidlerin birleşerek oluşturdukları büyük
plasmidlerde böyle durumlara rastlanabilmektedir. Ancak, replikasyonda bunlardan birisi
fonksiyoneldir. RO'lar, aslında nukleotidlerden oluşmuş bir DNA segmentidir. Bunun
uzunluğu, baz sayısı, sırası ve türü plasmidlere göre değişebilir. RO'lar A ve T
bazlarından zengindirler. Aşağıda
bazı doğal plasmidlerin
kendilerinde bulunan RO sekansları yanı sıra, diğer spesifik markerler de
belirtilmektedir. F
plasmidleri
: RO +
pilus formasyon genler R
plasmidleri
: RO + pilus formasyon genleri+antibiyotiklere dirençlilik
genleri Virulens
plasmidleri
:RO +
toksin genleri (B. anthracis 'te p0X1 ve Cl. teteni 'de nörotoksin) Bakteriosin
plasmidleri
:RO +
Co1E1, Col I, Col V, Pesticin, Cloacin, Megacin vs.
genler Metabolik
plasmidler
: RO +
bazı kimyasal maddeleri (SAL, ASL, TOL, NAH,
vs) ayrıştıran genler Plasmidler,
bazı restriksiyon endonuklease
enzimlerinin kesim yerlerine ve restriksiyon
haritalarına sahiptirler. Enzimler, türlerine göre, plasmidlerde değişik
sayıda (0,1,2 ve daha fazla) kesmeler yaparak değişik boylarda DNA segmentlerine
ayırırlar. Bazı
enzimlerin (Bst II, Hpa I ve Xba I) plasmidde (pBR322) hiç bir kesim yeri
bulunmamaktadır. Buna karşın, Hpa II'nin bu plasmidde 26 yerden kesme yeteneği
vardır. Ancak, gen klonlanmasında kullanılacak vektörlerde, bazı enzimler için
sadece bir kesim yerinin bulunması ve bu yerin de spesifik markerlerden birinin
üzerinden olması, genin inaktivasyonu için arzu
edilen bir durumdur (EcoR I, Pst I, gibi). Çeşitli
antibiyotiklere dirençlilik gösteren mikroorganizmalarda, bu özellik, kromozomal bir
karakter taşıyabileceği gibi plasmidlerde bulunan özel genler tarafından da spesifiye
edilebilirler. Plasmidlerdeki rezistenslik genleri, genellikle, yer değiştirebilen genetik elementler (transposon) tarafından karakterize edilirler.
Diğer bir ifade ile, transposonların yapısında antibiyotiklere dirençlilik sağlayan
enzimlerin kodları bulunmaktadır. Doğal
plasmidlerin yapısında yer alan önemli sekanslar arasında, replikasyon orijini (RO) başta olmak üzere,
özel bazı karakterleri spesifiye eden markerler, transposonlar ve İnsersiyon sekansları (İS-elementleri) da bulunmaktadır. Bu özel sekanslar
aynı zamanda genomda var olabilirler. Gen
klonlanmasında, doğal plasmidler, restriksiyon haritalarının ve taşıdıkları
spesifik markerlerin uygun olmaması nedeniyle, pek fazla tercih edilmemektedir. Bunların
yerine, amaca yönelik olarak gerekli sekanslara sahip (başta RO olmak üzere diğer
spesifik markerler) plasmidler hazırlamak ve başarı ile kullanmak mümkündür (suni plasmidler). Böyle plasmidlerin hücre
içindeki ekspresyonları da kontrol edilebilmektedir.
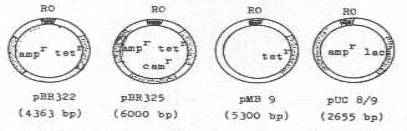
Aşağıda,
bazı suni plasmidlerde amaca yönelik olarak ilave edilen bazı spesifik markerler
gösterilmektedir. pMB 9
(5300 bp) :
RO + tetr pBR322
(4363 bp) : RO + ampr+
tetr pNEO
(5510 bp) :
RO + ampr+ neor pBR
325 (6000 bp) : RO +
ampr + Camr+ tetr pUC
8/9 (2655 bp) : RO +
ampr+lac Gen
klonlamasında, yukarda açıklanan sekansların yanı sıra, plasmidlere hücre içinde
hedef genin ekspresyonu artırmak için bazı özel baz sıraları, kodonlar, genler vs.
daha katılabilir. Örn., yabancı gen
(hedef gen), başlatma ve terminatör kodonlar,
kuvvetli promotorlar ve bazen de beta
galaktozidaz enzimini kodlayan sekanslar. Bunlar, plasmidin hücre içinde kolayca
algılanabileceği ve aynı zamanda, RNA polimerase enziminin kolaylıkla tanıyabileceği
ve transkripsiyonu yapabileceği nukleotid sekanslarıdır. Hedef gene bağlanan promotor
ne kadar kuvvetli olursa genin ekspresyonu da o kadar çabuk ve fazla olur. Promotorlar,
aktarılan özel genlerin (hedef genler) önemli ekspresyon güvencesidirler. Bazı
durumlarda da, hazırlanan vektörlerin yapısına hem plasmidden ve hem de fajlardan
bazı önemli bölgeler ilave edilerek kapasiteleri genişletilmektedir. Şöyle ki, Kosmidlerde (Cosmid), hem pBR322'ye ait RO ve hem de dirençlilik genlerinden biri veya ikisi
bulunduğu gibi, ayrıca, E. coli ye ait olan lambda fajının da Cos (cohesive ends, yapışkan uçlar) bölgeleri
katılarak etkinliği artırılmıştır. Kosmidlerde bulunan Cos bölgesi içine yabancı
gen aktarılarak E. coli 'ye
transfer edilir ve bu hücre içinde genin ekspresyonu sağlanır. Bazen de fajların
diğer sekansları da aynı amaç için kullanılarak elde edilen klonlama vektörlerine (fajmid, phagemid) yabancı genler inserte
edilerek bakteriye transfer edilir. Örn, pBR322 plasmidine ait RO ve ampr sekansları ile, T3 ve T7 fajlarına ait
promotorları taşıyan fajmid (pT7T318U, 2890 bp) gibi. Buraya
kadar bahsedilen vektörler, genellikle "prokaryotik
ekspresyon vektörleri ve multifonksiyonel
vektörler"olarak tanımlanmaktadırlar. Bunlar için genellikle bakteriler
alıcı hücre görevi yaparlar. Yine
benzer tarzda hazırlanan ve hem prokaryotiklerde (bakterilerde) ve hem de ökaryotik
hücrelerde eksprese edilebilen, her iki gruba da ait replikasyon orijini, promotor ve
diğer sekanslar içeren mekik vektörler (shuttle vector) veya sadece ökaryotikler için
özel, ökaryotik ekspresyon vektörleri hazırlanabilir ve ökaryotik
hücrelerde klonlanabilir. Vektörlerin
türleri, yapısı ve kullanılmaları hakkında gerekli bilgiler "Mikrobiyolojide
Biyoteknoloji" adlı
kısımda verilmiştir. 04. Plasmidlerin Sınıflandırılması Bakteri
plasmidleri çeşitli özellikleri dikkate alınarak bazı klasifikasyonlara tabi
tutulmuştur. Ancak, yine de tam yerleşmiş ve bütün kriterlere uyabilecek veya cevap
verebilecek bir sınıflama yapılmış değildir. Bunlardan bazılarına ait bilgiler
aşağıda özetle verilmektedir. 1)
Büyüklüklerine göre sınıflama: Bazı
araştırıcılar plasmidleri büyüklüklerine veya molekül ağırlıklarına göre 3
gruba ayırmaktadırlar, a)
Küçük (mini sirküler) plasmidler: Bunlar
1-10x106 dalton
ağırlığındadırlar b)
Orta plasmidler:
Bunlar, 10-50x106 molekül
ağırlığındadır. c)
Büyük plasmidler: Bu
ölçülerin üstünde molekül ağırlığına sahip olanlar. Ancak,
yukarda belirtilen molekül ağırlığı kriterleri ve isimlendirmeler yazarlara göre
değişmektedir. Bu konuda tam bir standardizasyon yoktur. 2)
İnkompatibilite durumlarına göre sınıflama: Bakteri
plasmidleri, aynı hücrede birlikte bulunup bulunmadıklarına göre iki kısma
ayrılmaktadır. Eğer, birden fazla plasmid aynı bakteride uyum içinde bulunabiliyorsa
bunlar kompatible grubu içine dahil
edilmektedirler. Eğer birlikte uyum içinde olamıyor ve birbirlerini itiyorlarsa bunlar
da inkompatible plasmidler olarak kabul
edilmektedirler. Bu son grubu, aynı zamanda, birbirlerinin üremelerine veya biri
diğerinin replikasyonuna da mani olmaktadır. Plasmidler bu özelliklerine göre gruplara
(FI, FII, FIIII, X, PI, Ia, vs) ayrılmaktadırlar. E.coli 'de 20'den fazla, stafilokoklarda 15 ve
pseudomonaslarda da 11 inkompatibilite grubu belirlenmiştir. 3)
Konjugatif özelliklerine göre sınıflama: Küçük (1-10 kbp uzunlukta) plasmidler
kendilerini bir bakteriden diğerine transfer edebilecek genetik bilgilere sahip
değildirler. Bu nedenle nonkonjugatif bir özellik taşırlar. Bunların
transferi, aynı bakteri içinde bulunan diğer konjugatif plasmidlerce sağlanır veya
bakteri kromozomu ile birleşerek veya genel transdüksiyonla gerçekleştirilir. Bu tür
plasmidler, yapılarında seks pilusu formasyonu için de genetik kodlar taşımazlar.
Halbuki, büyük plasmidlerin DNA'larında seks pilusu için informasyonlar bulunur ve
kendilerini bu pilus aracılığı ile başka hücrelere kolayca transfer edebilirler (konjugatif plasmidler). 4)
Taşıdıkları spesifik sekanslara göre sınıflama: Plasmidlerin
en önemli özelliklerinden birisi, kuşkusuz, DNA'larında bazı özel informasyonların
(markerler) kodlarına sahip
olmalarıdır. Konjugatif plasmidler bu özelliklerini transfer edebilme
yeteneğindedirler. Bu markerlere göre plasmidler 5 gruba ayrılırlar 1-F
faktörü (seks pilusu), 2-
Rezistenslik plasmidleri, 3-Virulens
plasmidleri, 4-Bakteriyosin
plasmidleri 5-Metabolik
plasmidler 05. Plasmidlerin Bakteride Saptanması Bakteriyel
populasyonlarda plasmidlerin varlığını belirlemede fiziksel, morfolojik ve fonksiyonel
testlerden yararlanılmaktadır. Bakterilerin,
bazı özel karakterleri çabuk kazanması
ve bunları nesillere transfer etmesi veya bunları çabuk kaybetmesi, bu özelliklerin
plasmidlerce kodlandığının bir işareti olarak kabul edilmektedir. Önceden bazı
özelliklere sahip olmadığı bilinen bakterilerin müteakip pasajlarında yeni
karakterler kazanması ve bunları yeni nesillere transfer etmesi aynı şekilde bunların
plasmidle ilişkili olabileceğini düşündürebilir. Örn, laktoz negatif olan
salmonellalarda laktoz pozitif suşların ortaya çıkması gibi. Nonkonjugatif
plasmidler veya herhangi bir özel karakter taşımayan plasmidler yüksek tuz konsantrasyonunda sentrifugasyonu
kromozomal DNA ile Plasmid DNA'sını birbirinden ayırmada faydalı olmaktadır. Şöyle
ki, iki DNA densite bakımından farklı özellik gösterdiklerinden, santrifüj tüpünde
ayrı yerlerde lokalizasyon gösterirler. DNA
ekstraktları eğer dikkatlice hazırlanır ve DNA'nın parçalanması önlenirse, elektroforezisde iki DNA molekülü ayrı
yerlerde lokalize olurlar. Plasmid DNA'sı karşı uçta yer alırken, büyük olan
kromozomal DNA başlangıç yerinde (veya buraya yakın) kalır. Elekron
mikroskopla da
plasmid DNA'sı kolayca görüntülenebilir. Plasmid DNA'sı kromozomal DNA'dan,
büyüklük farkı nedeniyle kolayca ayırt edilebilir. Sitoplasmada
serbest bulunan plasmidlerin saptanması, kromozomla integre olmuşlardan, daha kolaydır.
Ancak, nukleusla birleşenleri saptamak için spesifik işaretli problardan yararlanılabilir. Ethidium bromide içeren caesium chloride densite gradient sentrifugasyonda da sirküler plasmid DNA'sı dibe yakın yerde, kromozomal DNA ise bunun üstünde bant oluşturur. 06. Plasmid DNA'sının İzolasyonu Bakterinin
içinde plasmidin varlığı saptandıktan sonra, kromozom segmentleri ile kontamine
olmadan plasmidleri çıkarmak ve bazı özelliklerini belirlemek mümkündür. Bu amaç
için, genellikle, sitoplasmada bulunan plasmidler tercih edilirler. Gram
negatif mikroorganizmalardan plasmidleri izole ve karakterize etmek için bazı, pratik ve
kolay yöntemler bulunmaktadır. Bunlardan biri aşağıda özetle belirtilmiştir.
Yöntemlerin seçimi araştırıcıların becerilerine, bilgilerine göre ve laboratuvar
olanaklarına değişebilir. 1)
Bakteri içinde, sitoplasmada, plasmidin fazla olması veya kopya sayısının
artırılması (besi yerine chloramphenicol 150 mg/ml
katılarak) izolasyon için iyi bir başlangıç veya adım olur. 2)
Bakterinin sıvı ortamda 18-24 saatlik saf kültürü yapılır ve kuvvetli
santrifugasyonla çöktürülür. Üst taraf atılır. 3)
Dipteki tortuya EDTA (ethylendiamine tetra acetic acid)
katılarak hücre duvarındaki dış membran ve sonra da lizozim ilave edilerek, bu tabakanın altında bulunan
ince peptidoglikan katmanı giderilir. Bu iki işlemin sonunda sferoplastlar elde edilir. 4)
Sferoplastların hemen parçalanmasını önlemek için ortama sukroz katılır. 5)
Suspansiyon, SDS (sodium dodecyl sulfate)
ile muamele edilerek sferoplastlar parçalanır. 6)
Karışım, RNase ve Proteinase K ile muamelede edilerek ortamda
bulunan RNA ve protein karakterindeki moleküller de giderilirler. Böylece, suspansiyonda
sadece DNA'lar kalmış olur. 7)
Ortamda bulunan hücre artıkları, büyük kromozomal segmentler ve diğer debrisler
santrifugasyonla giderilirler. Tortu atılır ve üst taraf muhafaza edilir. 8) Ethidium bromidli caesium chloride densite gradient sentrifugasyona
tabi tutularak, plasmid DNA'sı (altta), kromozomal DNA'dan (orta yerde bant oluşturur)
ayrı yerlerde bantlar oluşturarak ayrılabilirler. Ancak bu yöntemle kesin bir ayırım
yapılamaz. Çünkü, plasmidlerin bazı formları kromozomun bulunduğu yerde lokalize
olabilirler. Ortamın
pH'sını
12-12.5 arası ayarlamak plasmid DNA'sı ile kromozomal DNA'yı ayırmada faydalı
olabilmektedir. Yüksek pH, kromozomal DNA'yı denatüre etmesine karşın, kapalı
sirküler plasmid DNA'sına etkilenmemektedir. Yüksek
tuz konsantrasyonunda
kromozomal DNA presipite olmasına karşın plasmid DNA'sı suspansiyon içinde kalır. Suspansiyon
santrifüje edilerek çöken kromozomal DNA'ya pek fazla dokunmadan üstteki sıvı bir
pastör pipeti ile çekilerek alınır, saflaştırılır, kontrolleri yapılarak
denemelerde kullanılır. 07. Plasmid Eliminasyonu
(Curing, Plasmid Eksklusyonu) Bakteriler,
türlere göre değişmek üzere bir çok spesifik karakterlere sahiptirler. Bu
özelliklerin çoğu kromozomal orijinli (genoma bağlı) olmasına karşın, bazıları
da plasmidler tarafından kodlanmaktadırlar. Bu iki durumu birbirinden ayırmak için plasmid eliminasyon testi yapılır. Başlangıçta,
bakteride saptanan bazı özelliklerin, eliminasyon denemesinden sonra kaybolması ve
böyle durumun generasyonlar boyunca devam etmesi halinde, kaybolan karakterlerin
bakteriden ayrılan plasmidlerle ilişkili olacağı anlaşılır. Eğer, hiç bir
değişiklik olmazsa, o zaman bu özel karakterlerin kromozoma bağlı olduğu
düşünülebilir. Ancak, bu yargıya varabilmek için, a)
Denemenin iyi düzenlendiğinin, yürütüldüğünün ve sonuçlandırıldığının
kesinlik kazandırılmasına, b)
Plasmidin bakteride bulunduğunun kesin belirlenmesine, c)
Kullanılan kimyasalların, deneme veya amaç için uygun olduğuna, d)
Plasmidin bakteriden çıktığının belirlenmesine, gereksinim vardır. Plasmid
eliminasyon testinde, genellikle, kimyasal maddeler (acridin orange, acriflavine, ethidium bromide,
mitomycin C,optimalin üstündeki ısı derecelerinde üretme, UV-ışınları, iyonizan ışınlar, vs) fazla
kullanılır. Plasmidlerin
bakteriden ayrıldığını anlamak için başlıca iki klasik yöntem kullanılmaktadır.
Bunlardan biri, plasmid transfer testi olup ortama geçen serbest
plasmidler, başka bir indikatör mikroorganizma tarafından alınarak, bu son bakteride
görülen yeni değişmeler dikkate alınır. Diğer bir ifade ile, indikatör
mikroorganizma, plasmidlerin taşıdığı yeni karakterleri alarak pozitif hale gelirler.
Bunda başarılı olabilmek için, indikatör mikroorganizma çok dikkatli seçilir ve
ortama CaCl2 katılarak
permeabilitesi arttırılır ve böylece transfeksiyon kolaylaştırılır. Bu
karakterler, dirençlilik veya metabolik plasmidler, vs olabilir. Diğer teknik ise, selektif ortamların kullanılmasıdır. Özellikle,
antibiyotiklere duyarlılığın oluştuğunu veya fermentasyon durumunu ortaya koyabilen
özel selektif besi yerleri bu amaç için kullanılabilir Plasmidler
bakterilerden fiziksel ve kimyasal yöntemlerle çıkabilecekleri gibi, spontan olarak ta
bakterilerden ayrılabilirler. 08. Plasmid Replikasyonu Plasmidler,
hücre içinde, aynen bir bakteri kromozomu gibi replikasyon modeline sahiptirler.
Üzerinde en fazla çalışılan ColE 1 plasmidin replikasyonu hakkında kısa ve özlü
bilgiler verilecektir. ColE I
plasmidi (4.3x106 dalton), sirküler,
süpersarmal, çift iplikçikli bir DNA molekülüdür. E. coli 'de yaklaşık 15 kopyası bulunur ve her bir
30000 molekül ağırlığında 8 proteini kodlayabilir. Replikasyonu için tümden
konakçı proteinlerine gereksinimi vardır. Kendisi ayrıca, Colicin E1 proteinin de
kodlarına sahiptir. Bu plasmidin bakteri içinde replikasyonu tek yönlüdür (unidireksiyonal). Replikasyonun
başlangıcında, konakçıya ait RNA polimerase enzimi replikasyon orijininden 555
nukleotid çifti (bp) kadar sol tarafa (5' -ucuna doğru) yerleşerek RNA II sentezini
başlatır ve replikasyon için primerlerin sentezi gerçekleştirilir. Bu primerler, Okazaki segmentleri için basamak oluştururlar.
Replikasyonun başlangıç noktasında plasmid DNA'sında açıklık (aralık) meydana gelerek ve polimerizasyon (yeni
iplikçik sentezi) oluşan bu açıklık içinde ve tek yöne (unidireksiyonal) doğru gelişerek parental iplikçiklerin
karşısında yeni iplikçikler sentezlenerek devam eder ve tekrar orijin noktasına kadar
ilerleyerek son bulur. Replikasyonun mekanizması aynen bakterilerde olduğu gibidir.
Yani, parental iplikçiğin 5'-ucu karşısındaki yeni sentezlenen iplikçik kesintilidir
(ters yöndedir, 3'¬ 5'),
buna karşın parental iplikçiğin 3'-ucunun karşısında sentezlenen yeni iplikçik ise
5' ® 3'
yönündedir. Bu yön polimerase enziminin aktivite yönüne uygun olduğu için sentez
kesintisizdir. Diğer iplikçikte ise, primerler ve Okazaki segmentleri meydana gelir. R-plasmidlerinden olan R1, R100 ve R6-5'de
unidireksiyonal replikasyon tarzı bulunmaktadır. E.
coli
'ye
ait bazı plasmidlerin (özellikle konjugatif karakterde olanlar) replikasyonu iki yönlü
olabilmektedir (bidireksiyonal). Bu model replikasyon, bakteri
kromozomunun sentezine aynen uymaktadır. Replikasyon çatalı iki yönde ilerleyerek
belli bir noktada birbirleriyle birleşirler. Plasmidlerde
replikasyon orijini genellikle, tek olmasına karşın bazı F-plasmidinde iki ve R6K'de
ise 3 tane RO'nun bulunduğu açıklanmıştır. 09. İnkompatibilite Bakteriler,
genellikle, aynı tür plasmidin bir veya daha fazla kopyasına sahip olabilmektedirler.
Büyük plasmidler 1-2 kopyadan fazla olmamalarına karşın, küçük plasmidler hücrede
daha fazla (> 20) sayıda bulunabilmektedirler. Bir arada olabilen ve çoğalabilen bu
plasmidler birbirleri ile uyum içinde bulunurlar (kompatibilite).
Ancak, bazı plasmidler aynı bakteride bulunamazlar, birbirlerinin üremelerini
kısıtlarlar veya eliminasyonlarına neden olurlar (inkompatibilite). Örn. E. coli 'ye ait olan F plasmidi ya sitoplasmada serbest
olarak veya bakteri kromozomu ile birleşik olarak (Hfr hücre) bulunur. İki tarz
birlikte E. coli 'de bulunamaz. Bir
bakteriye inkompatibl iki plasmid transfekte edildiğinde, 2-3 generasyon sonra bunlardan
biri çıkarılır ve tek tür plasmid haline gelir. Böylece biri elimine edilir.
Genellikle, aynı tür plasmidler birbirleri için inkompatibil bir karakter taşırlar. Ancak,
gen klonlanmalarında bazen gen amplifikasyonunu sağlamak amacıyla aynı plasmidin çok
sayıda kopyası elde edilebilmekte (kloramfenikollu
bezi yerinde üretilerek) veya küçük plasmidlerin bir bakteride çok sayıda kopyası
bulunabilmektedir. Böyle durumlara, bir
bakteri de aynı plasmid için birçok replikasyon yerinin olmasının rolü yanı sıra
diğer bazı faktörlerinde etkinliği vardır. İnkompatibilite
olgusu, hücrelerde plasmid replikasyonu ve plasmidin bölünen iki hücreye taksimini
kontrol eden mekanizma ve ayrıca, plasmidlerin kopya sayısı ile yakından ilişkilidir.
Bir bakteride bulunan replikasyon mekanizması bir plasmid tarafından kullanılıyor ve
bloke ediliyorsa, aynı mekanizmadan yararlanan ikinci plasmid bu olanağa sahip
olamadığı için replike olamaz (kompetatif
inhibisyon). Bu durum aynı zamanda, aynı plasmid ile ikinci infeksiyona da mani
olur (immunite). ColE1 plasmidinde
inkompatibilite, RNA I olarak tanımlanan moleküllerle ilişkili bulunmaktadır. Bu
molekülün RNAII ile interaksiyonu, DNA'nın replikasyonunu önler. Böylece, plasmidin
replikasyonu sınırlanır. Eğer her iki plasmid, aynı RNAI ve RNAII moleküllerini
spesfiye ediyorsa, RNA I'in hücre içindeki konsantrasyonu, her iki plasmidin kopya
sayısını dengede tutar. İnkompatibilite
özelliği, plasmidleri sınıflamada yardımcı olmaktadır. Enterobakterilerde 30,
stafilokoklarda 15 ve pseudomonaslarda en az 11 inkompatibilite grubu belirlenmiştir. 10. Nonkonjugatif
Plasmidlerin Transferi Konjugatif
plasmidler kendilerini transfer edebilmek için gerekli informasyonlara sahip olmalarına
karşın nonkonjugatif olanların böyle
bir yetenekleri bulunmamaktadır. Ancak, konjugatifler, kendilerini transfer ettikleri
oranda, nonkonjugatifleri de mobilize ederek transferlerini sağlayabilirler. Örn.,
nonkonjugatif bir plasmid olan ColK-235 (MA: 5x106), konjugatif olan R144 drd3
plasmidi tarafından ve ColE 1 nonkonjugatif plasmidi de F- veya I-benzeri konjugatif
plasmidleri tarafından transferleri sağlanır. Mobilizasyon
bazı durumlarda, ne konjugatif plasmide bağlanarak bununla birlikte (kotransfer) ve ne de bakterinin recA gen ürünü proteinine bağımlıdır.
Kendilerinin mobilizasyonunu sağlayan konjugatif plasmidler bu amaç için en az bir
proteinin kodlarına sahiptirler. 11. Plasmid Profil Analizi (Plasmid
Fingerprint Testi) Bu
test, bakterilerde plasmidlerin varlığını ortaya koyduğu gibi plasmid türlerini
belirlemede de yardımcı olmaktadır. Bakterilerde aynı molekül ağırlığında
olanlarla farklı olanların fingerprintleri, agarose jel üzerinde farklı yerlerde
lokalizasyon gösterdiklerinden, bu durumları teşhiste büyük kolaylıklar
sağlamaktadır. Bu
test kısaca şöyle uygulanır. 1)
Plasmid taşıyan bakterinin sıvı ortamda (veya agarda) taze kültürü yapılır. 2)
Kültür santrifüje edilerek tortu (mikroorganizmalar) lize edilir. 3) Plasmid DNA ile bakteri DNA'sı birbirinden ayrılır. 4)
Plasmid DNA'sı, agarose jele tatbik edilerek elektroforetik
seperasyona tabi tutulur. 5)
Jel, metilen mavisi (veya başka bir boya
ile) boyanır ve UV-ışınları altında boyanan
bantlar kontrol edilir. 6)
Bantların yerleri belirlenir (Farklı büyüklükteki plasmidler değişik yerlerde bant
oluştururlar). Küçük
plasmidler jel içinde daha hızlı hareket ederek karşı uçta yerleşmelerine karşın
büyük plasmidler de molekül ağırlıklarına göre başlangıç yeri ile karşı uç
arasında bir lokalizasyon gösterirler. Bantlar, "standart plasmid molekül ağırlığı"
ile karşılaştırılarak bantların yerleri ve molekül
ağırlıkları saptanır. Aşağıda
moleküler ağırlık standardı olarak
kullanılan bazı plasmidler ve bunların molekül ağırlıkları gösterilmektedir.
12. Başlıca Plasmidler ve
Özellikleri Bakterilerde,
karakterleri çok değişik olan doğal plasmidler bulunmaktadır. Taşıdıkları özel
genlere dayalı olarak bunları 6 grup altında incelemek mümkündür. 1) F
plasmidi (fertilite faktörü, F faktörü, seks faktörü) 2)
Rezistenslik plasmidleri (R plasmidleri, R faktörleri) 3)
Virulens plasmidleri 4)
Bakteriyosin plasmidleri 5)
Metabolik plasmidler 6)
Büyük plasmidler 12.1. F plasmid (F Faktörü, Seks Faktörü) F
faktörü (fertilite faktörü) en iyi E.
coli K 12 suşlarında incelenmiştir.
Bir plasmid olan F faktörü, sirküler, sarmal ve çift iplikçikli otonom bir DNA
molekülüdür (MA: 63x106 dalton, 95
kbp uzunlukta ve hücre de 1-3 tane kadar). Konak bakterisinin yaklaşık %2'si kadar
uzunlukta olan bu plasmid, yapısında replikasyon
orijininden (RO)'dan ayrı olarak
kendisinin transferini sağlayabilecek ve pilus
formasyonunu kodlayan bilgilere sahiptir (Tra
operonda 21 gen). Bu plasmid hangi hücreye aktarılırsa, o bakteride hücre
membranında pilus sentezi (pilus formasyonu) meydana gelir. Bu pilus (seks pilusu), bu
faktörü taşımayan alıcı hücrenin (F- hücre),
verici hücre ile (F+ hücre)
bağlantı kurmasına ve bir konjugasyon
köprüsü oluşturmasına yardımcı olur. F faktörü konjugatif (transmissible) bir
plasmiddir. F
faktörü bakterinin sitoplasmasında bulunabileceği gibi, konakçının genomuna da
integre olabilir ve Hfr (high frequency
recombination) hücre meydana gelir. F
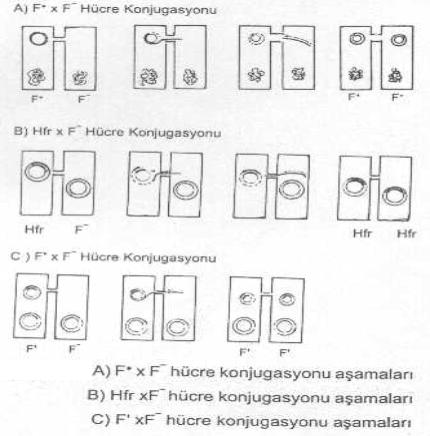
plasmidi ile başlıca 3 tür konjugasyon oluşabilmektedir. Bunlar da, 1)
F+ hücre x F- hücre konjugasyonu: F
faktörünü sitoplasmasında taşıyan bir F+
hücre ile buna sahip olmayan F-
hücre arasında gerçekleşen F faktörü aktarılmasında seks pilusu önemli fonksiyona
sahiptir. Ancak, böyle iki hücrenin direkt teması da genetik madde aktarımına
yardımcı olabilmektedir. F+ hücre
x F¯ hücre birleşmelerinde genin aktarımı tek yönlüdür. Yani vericiden
alıcıya doğrudur. İki yönlü olmamaktadır. Ayrıca, F+ hücre ile F- hücre birleşmelerinde de alıcı hücre her
zaman F+ hücre şekline
dönüşmeyebilir. Konjugasyon sırasında, F faktörünün bir iplikçiğinde oluşan
kopma (ori T bölgesi) ve buradan ayrılan
5' ucu, seks pilusunun oluşturduğu köprüden geçerek F- hücreye transfer edilir. Aktarılan tek
iplikçiğin karşısında 5' ¬ 3'
yönünde ikinci bir iplikçik sentezlenerek alıcı hücrede çift iplikçikli ve sonra
da sirküler forma dönüştürülür. Böylece başlangıçta F- olan alıcı hücre F+ hale dönüşmüş olur. Vericide bulunan tek
kopya da rolling circle replicationla
çift iplikçikli forma getirilir. Böylece verici hücre de yine plasmid kalmış ve bu
hücre F+ karakterini korumuş olur. Alıcı
hücreye aktarılan F plasmidi, burada sitoplasmada kalır. Nadiren bakterinin genomuna da
integre olabilir ve hücreyi Hfr haline getirebilir veya bazen de hücreden ayrılabilir. Genetik
materyalin, vericiden alıcıya aktarılmasında seks pilusunun çok önemli fonksiyonu
olmasına karşın, aktarım bazen, direkt temas sonunda da meydana gelebilmektedir. 2)
Hfr hücre x F-hücre konjugasyonu: F
faktörünün alıcı hücrenin kromozomu ile birleştiği durumlarda, bakteride seks
pilus formasyonu çok daha fazla sıklıkta meydana gelir ve buna bağlı olarak ta gen
transferi çok daha yüksek oranda gerçekleşir. Hfr hücrelerde, kromozom üzerinde
lokalize olan F faktöründe iplikçikte oluşan kopma sonu ayrılan 5'-ucu konjugasyon
köprüsüne girerek buradan alıcı (F- hücre)
hücreye transfer edilir. Ancak, bağlı bulunduğu konakçı genomundan da bir segmentin
veya nadiren tüm kromozomun da, tek iplikçik halinde, alıcıya aktarılmasını
sağlayabilir. Alıcıya geçen tek iplik F faktörü ve/veya kromozom segmenti burada
çift iplikçikli ve sirküler forma dönüştürülür. Vericide kalan tek iplikçik F
faktörü rolling circle replication ile çift iplikçik haline
getirilir. Eğer genomdan bir segment (tek iplikçik) gitmişse, bu da karşı iplikçik
kalıp olarak kullanılarak yeni iplikçik sentezlenerek çift iplikçikli hale getirilir. Alıcı
hücreye aktarılan F faktörü veya F faktörü + kromozom segmenti, ya alıcı hücrenin
genomuna integre olur ve bu hücreyi de Hfr haline getirir veya F plasmidi, hücre
sitoplasmasında da kalabilir. F+ hücrelerden F- hücrelere aktarılan F plasmidinin alıcı
hücrenin kromozomu ile integre olma olasılığı 10-5-10-6
arasındadır. Kromozomla birleşme geriye dönüşlü de olabilir. Yani F faktörü
genomdan ayrılabilir. DNA transferi belli bir hız ve belli bir yerden başlayarak devam
eder. Bu hız 37°C 'de bir saat içinde yaklaşık 105 nukleotid çifti kadar olduğu
belirlenmiştir. F+ hücrelerden alıcıya F faktörünün
transferi oranı genellikle düşüktür. Çünkü, pilus formasyonu, Hfr hücrelere göre
daha azdır, Ayrıca direkt kontakla yapılan
transferlerde de, sıvı ortamda bakteriler serbest olarak bulunduklarından ve
aralarında az da olsa bir mesafe olduğundan direkt temas oldukça sınırlı
kalmaktadır. Bazı durumlarda mikroorganizmalar sıvı ortamda kümeler tarzında veya
birbirlerine bağlı olarak da üreme gösterebilirler. Ancak, böyle kümeler tek bir
mikroorganizmadan oluşması nedeniyle hepsi aynı karakteri yani hepsi F- olabilirler. Katı ortamlarda da üreyen koloniler,
aynı şekilde, tek bir mikroorganizmadan kaynaklandığı için aynı sorun burada da
bulunmaktadır. F
faktörü, sadece E. coli suşları arasında transfer edilmez. Aynı zamanda,
salmonella, shigella, pseudomonas, proteus, vs cinslerine ait türlerde de meydana
gelebilir. F+ E. coli
suşları diğer Gram negatif
mikroorganizmalarla da konjugasyon yapabilir. Ancak; daha az sıklıkta bir gerçekleşme
elde edilir. Örn, E. coli ile
salmonella arasındaki konjugasyon oranı 10-6-10-8 kadardır. Salmonella ile shigella arasında
da buna benzer bir oran bulunmaktadır. F
faktörü bazı indükleyicilerin (akridin
boyaları, ethidium bromide, mitomycin C, vs) etkisinde veya spontan olarak
bakteriden çıkabilir (eliminasyon, plasmid
eksklusiyonu). Böylece, F+ hücreler F- hücre
haline gelebilirler. 3)
F' hücre x F- hücre konjugasyonu: Bazı
indükleyicilerin etkisi altında, Hfr hücrelerinde kromozomda yerleşik bulunan F
plasmidi buradan ayrılabilir. Bu ayrılma tam veya kısmi olabildiği gibi bazı
durumlarda da kromozomdan da bir segmentin veya genin birlikte çıkmasına neden
olabilir. Kısmi ayrılmalarda ise, plasmidin bir bölümü bakteri kromozomu üzerinde
kalır.
Bakteri
genomundan bir segmentin F plasmidi ile birlikte çıkması (F' plasmidi) durumunda oluşan F' hücre ile F- hücre konjugasyonlarında, bakteri genomu da
alıcı hücreye çok nadiren transfer edilebilir ve bu bakteriyi, aktarılan faktör
yönünden pozitif hale getirebilir. Ancak, çoğu kez bakteri segmenti transfer edilmez
veya aktarılsa bile kromozomla birleşmeyebilir. Konjugasyonun
önemli olan yanlarından biri de, kesintili konjugasyon denemeleri ile bakterinin
zamana karşı kromozom lokalizasyonlarının
haritasını yapmak mümkündür. Böylece hazırlanan kromozom haritalarında hem
genlerin yerleri ve hem de aktarılma süresi içinde zamanları da belirlenmektedir. F
faktörünün bakteri kromozomuna integrasyonunda her ikisinde bulunan İS-elementlerinin rolü olduğu
bildirilmektedir. Bakterideki İS-elementi ile F plasmidinde bulunan İS-elementi
karşılıklı gelerek çapraz integrasyonla F faktörü kromozoma integre olur. 12.2. Rezistenslik Plasmidleri (R
Plasmidleri) Enterobakteriler
arasında çeşitli ilaçlara karşı dirençlilik, hem in vitro ve hem in vivo olarak
saptanmıştır. İlk defa bu özellik, 1951 yılında Japonya'da seyreden bir dizanteri
olgusundan izole edilen S. flexneri suşunun
4 antimikrobial maddeye (kloramfenikol, tetrasiklin, streptomisin ve sulfonamid) karşı
dirençli olduğu belirlendikten sonra anlaşılmıştır. Bu etkenin dışında, birçok
ilaca karşı çoğul dirençlilik E. coli, salmonella, shigella, Klebsiella,
proteus ve bazı enterobakterilerde de rastlanmıştır. Daha sonraları antibiyotik
sayısında, dirençlilik yönünden artmalar olmuş ve yukardakilere ilaveten ampisilin,
kanamisin, neomisin, vs gibi antibiyotiklere çoğul dirençlilik gösteren suşların
sayısında artmalar meydana gelmiştir. R
plasmidleri çift iplikçikli sarmal, sirküler ve
yapıda DNA karakterinde genetik elementlerdir. Molekül ağırlıkları >50x106 kadar olup genellikle konjugatif bir
özelliktedirler Bakteri kromozomu ile de
integre olabilirler. R
faktörleri iki bölümden oluşurlar. Biri konjugasyonu ve aktarılmayı yöneten transfer faktörü (TF) ve diğeri de çeşitli ilaçlara
karşı dirençliliği tayin eden rezistenslik
faktörü (RF) veya R determinanttır.
E. coli 'de bu iki faktör tek bir
ünite halinde bulunmasına karşılık salmonella ve proteuslarda bunlar ayrı sekanslar
halindedirler. Bu faktörler birbirlerinden bağımsız olarak aktarılabilirler ve
akridin boyalarından da ayrı ayrı etkilenirler. Eğer, RF transfer edilirse alıcı
hücre ilaçlara karşı dirençli hale gelir. Ancak, RF'nin, TF olmadan tek başına
aktarılması olanaksızdır. Bu nedenle RF'nin aktarılması diğer mekanizmalar
tarafından yönetilir. Patojenik
bakteriler, kendilerinde bulunan R faktörlerini nonpatojenik olanlara transfer edebilir.
R plasmidleri, aynı zamanda, bazı faktörleri, diğer plasmidlerle birleşerek veya
transpozonlardan alabilirler. Bazıları da R faktörlerini amplifiye edebilir veya
plasmid sayısı (kopya sayısı) artırılabilir. Böylece bakteriler arasında rezistenslik konsantrasyonu çoğalmış olur. RF ve
TF'yi ayrı üniteler halinde bulunduran suşlarda ya biri veya ikisi birlikte transfer
edilebilir. R
faktörleri, etkilerine göre karakterize edilebilirler. Bazıları fertiliteye mani olur
ve F pilus oluşumunu baskılar (fi+, fertilite inhibisyon pozitif),
bazıları da etkilemez (fi-, fertilite inhibisyon negatif). Ancak, fi+ faktörü, F faktörünün aktivitesini
sınırlandırır. Buna karşın, fi-, F
faktörünün etkinliğine tesir etmez. Bazen de bir hücrede fi+ ve fi- faktörleri
bir arada bulunabilirler. Bu durum, aynı hücrede her iki faktörün replikasyon için
aynı bağlanma yerine sahip olmadıklarını göstermektedir. R
faktörü taşıyan hücrelerde, F piluslarına benzeyen piluslar (R pilusu) oluşmaktadır(R-plus formasyonu). Bu pilus da R faktörünü
transferde bir konjugasyon köprüsü oluşturur ve genetik materyalin aktarılmasında
önemli rol oynar. R faktörü, çeşitli antibiyotiklere karşı dirençliliği tayinde
rol alan genlere sahiptir. Şimdiye kadar, 7-8 antibakteriyel maddeye karşı rezistenslik
tespit edilmiş olup bunların da tek bir R faktöründe toplanabileceği belirlenmiştir.
Bir bakteride, ilaç dirençliliği oluşursa, bu zamanla çok yönlü R faktörüne
dönüşebilir ve diğer Gram negatiflere de aktarılabilir. Antibiyotikler
alındığında, bunlara duyarlı olan mikroorganizmalarda azalmalar meydana gelirken,
dirençliler de ise bunların yerini alma ve çoğalma gözlenir. Bu arada, R
faktörünün de hem patojenik ve hem de nonpatojenik Gram negatiflere transferi artar.
Böylece, barsakta, R faktörünü taşıyan hücre sayısı çok fazla bir düzeye
ulaşır, komensal ve patojenikler arasında yaygın bir hale gelir ve hastalığın
nüksüne yol açar. Bu
tarz infeksiyonlara, Gram negatif etkenlerden ileri gelen infeksiyonların sağaltımında
kullanılan streptomisin uygulamasından sonra rastlanmaktadır. R
faktörünün bir kısmı, zamanla, spontan olarak veya antibiyotik baskısının
kalkması sonu, konakçı bakteriden ayrılabilir. Spontan kaybolmalarda R faktörünün,
kromozomla aynı anda bölünerek kardeş hücrelere aktarılması da rol oynar. P.
multocida,
S. aureus, Salmonella, Shigella, genellikle, ilaçlara
duyarlı, buna karşın Pseudomonaslar ise
dirençlidirler. Mutasyonlar
sonu da, antibiyotiklere karşı dirençlilik oluşabilmektedir. Ancak, bu tarz
rezistenslik, yukarıda açıklandığının aksine, ekstrakromozomal değil
kromozomaldir. Bakterilerde
bulunan restriksiyon endonuklease enzimleri yabancı orijinli genetik materyallerin
invazyonuna mani olur. Ancak, bu koruma işlevi her zaman başarılı olmaz ve yabancı
DNA segmentleri hücrelere girer ve kromozomla da birleşebilir ve mutasyonlara da yol
açabilir. R
faktörü, R+ hücrelerden R- hücrelere genellikle, konjugasyonla transfer
olmasına karşın Gram pozitiflerde (stafilokoklarda) genel transdüksiyonla aktarma
meydana gelir. R
faktöründeki çoğul dirençlilik, bunda bulunan transpozon (Tn) ve/veya İS-elementlerinden kaynaklanmaktadır. Çeşitli
antimikrobial ilaçlara ve metallere karşı dirençliliği sağlayan ve R plasmidlerince
kodlanan özellikler ve bunların mekanizmaları hakkında ayrı bir bölüm halinde, bu
kısmın sonunda, bilgi verilmektedir. 12.3. Bakteriyosin Plasmidleri Bakteriyosinler,
bazı bakteriler tarafından sentezlenen dar
spektrumlu ve letal etkili
proteinlerdir. Bakteriyosinlerin bir kısmı kromozomal olmasına karşın, bazıları da
plasmid orijinlidirler. Bakteriyosinler, ancak, kendini sentezleyen türden veya
konakçısına çok yakın olan mikroorganizmalara etkilidirler. Örn., E. coli tarafından sentezlenen colicin (kolisin, bakteriyosin), bunu sentezleyemeyen E. coli 'ler ile S. sonnei için letaldir. Ancak, diğer bazı
enterobakterilere de etkili olabilmektedir. Bu etki çok sınırlıdır. İnsan ve
hayvanlardan izole edilen E. coli suşlarının
yaklaşık %40 kadarının kolisinojenik olduğu
belirtilmektedir. Şimdiye kadar 20'den fazla ve ayrı özellikte kolisin izole edilmiş
olup bunlar A'dan V'ye kadar, büyük harflerle bir sıralamaya tabi tutulmuştur.
Bunların her biri, E. coli 'lerin
bazılarına etkili olmakta ve böylece bir konakçı spektrumu ve spesifitesi meydana
gelmektedir. Kolisin sentezleyen suşlar (kolisinojenik
suşlar) kendi oluşturdukları
kolisinlere dirençlidirler. Ancak, kolisin sentezlenmeyenler etkilenirler. Bakteriyosinler,
Gram negatif mikroorganizmaların yanı sıra bazı Gram pozitiflerce de (stafilokok,
streptokok, listeria, basiller vs) sentezlenebildikleri açıklanmıştır. Bakteriyosin
formasyonu için, bakterilerde, özel, bakteriyosinogenlerin
bulunması gereklidir. Bunlar, bakteriyosin sentezini spesifiye eden özel genler olup bir
kısmı ekstrakromozomal bir karakter taşırlar. Bir çok bakteride böyle genler
bulunmasına karşın, genellikle, baskı altında tutulurlar ve bakteriyosin
oluşturmazlar. Bu nedenle de hücre filtratlarında bakteriyosinlere çok az rastlanır
ve bazen de hiç bulunmayabilirler. Ayrıca, bazı bakteriyosinojenik suşlar da, aynen
bakteriyofajlarda olduğu gibi (lizojenik suşlar), bakteriyosin sentezi için
indüklenmeleri gerekmektedir. Bakteriyosin sentezleyen hücrelerde, özel bir pilus
formasyonuna rastlanmamaktadır. Bunları kodlayan genler, ancak F veya R faktörlerinin
oluşturdukları pilusların konjugasyon köprülerinden yararlanarak diğer bakteriye
aktarılabilirler. Fakat, Col E1 pilus formasyonunu tayin edebilir ve kendinin transferini
sağlayabilir. Bunun yanı sıra, çok az oranda da bakteri kromozomundan bir segmenti de
mobilize edebilir ve aktarıldığı hücreye taşıyabilir. Ancak, kromozoma integre
olmazlar. Bazı
kolisinler (Col E1), bazı E. coli suşlarında
bulunan özel bir plasmid (Col plasmidi)
tarafından spesifiye edilirler. E. coli 'lerin
genomunda doğal olarak kolisin sentezleyen bir gene rastlanamamıştır. Ancak, kendilerine kolisin geni transfer edilirse böyle E.
coli 'ler kolisin genini eksprese
edebilirler. Col
plasmidi kendi konakçı bakterisini, aynı kolisine karşı dirençli hale getirmesine
karşın, diğer kolisinlere duyarlı olabilirler. Örn., Col1 A plasmidi E. coli 'yi colicin
A 'ya karşı dirençli yapmasına karşın, colicin B ve diğer kolisin türlerine
duyarlıdır. Kolisinler,
etkilerine göre, E. coli 'ler, Fredericq tarafından 20 farklı tipe ayrılmış
ve bunlara A'dan V'ye kadar bir isim verilmiştir (Freedericq klasifikasyonu). Bu sistematikte, E.
coli 'lerin dirençlilikleri esas
alınmıştır. Ancak, bu sistematik pratiğe pek uymamaktadır. Şöyle ki, bir E. coli suşu, birden fazla türden
kolisin sentezlediği gibi, birden fazla türden kolisini kodlayabilmektedir. Bakteriyosinler
düşük molekül ağırlığında ve protein karakterinde substanslar olup her birinin
amino asit sıraları ile bazılarının bunları kodlayan genlerin bazılarının baz
sıraları saptanmıştır. Yapıları oldukça basit, karbonhidrat ve lipid molekülleri
yönünden de bazıları yoksundurlar. Bu nedenle bakteriyosinlerin plasmidler tarafından
spesifiye edilip-edilmediklerini saptamak oldukça kolay olmaktadır. Gram
pozitiflerce sentezlenen bazı bakteriyosinler, ayrı cinsten mikroorganizmalara da az da
olsa etkili oldukları açıklanmıştır. Ancak, bu özellikteki bakteriyosinlerin bir
kısmı kromozomal orijinlidirler. Şöyle ki, P.
aeruginosa 'nın aeruginocini (pyocin)
kromozomal genler tarafından spesifiye edilirler. Bakteriyosinler
proteazlar tarafından inaktive edilirler. Bazılarının morfolojileri de, elektron
mikroskopla yapılan muayenelerde, faj kuyruklarına benzediği açıklanmıştır. Kolisinlerin
ve diğer bakteriyosinlerin molekül ağrılıkları 12000-90000 arasında
değişmektedir. Kolisinlerin bazıları iki asimetrik protein molekülü olarak
sentezlenir. Bunlardan büyük olanı, duyarlı bakteriyi öldürür ve küçük alt
ünite ise kolisin immunite proteini aktivitesi gösterir. Bu alt ünite, kolisinin,
in vitro, etkisini inhibe etmesine karşın, büyük alt ünitenin bakteriyi öldürmesine
mani olacak etkinlikte değildir. İmmunite proteini kolisine sıkıca bağlanır. Gram
pozitif mikroorganizmaların plasmid orijinli bakteriyosinlerinin (streptococcin, staphylococcin, lactocin, vs) molekül ağırlıkları 10000-25000
arasındadır ve yapılarında lipid ve karbonhidratlar bulunmaktadır. Bu duruma göre lipoprotein veya glikoprotein özelliği taşımaktadırlar. Kolisinler
bazı antibiyotiklerden (Streptomycin, chloramphenicol) daha büyük molekül
ağarlığına sahiptirler. Böyle büyük moleküllerin bakterilerin hücre duvarından
içeri girmeleri oldukça zordur. Ancak, bakteriyosinler bir çok tarzda hedef bakteriyi
etkileyerek lize ederler. Kolisinlerin hücre membranına bağlı enzimleri aktive ederek
veya bazıları da hücre membranından içeri girerek, DNA ve RNA'ların
fonksiyonlarını bozarlar. Kolisinler, daha ziyade, RNase ve DNase gibi etkinlik
gösterirler. Bazıları da hücre membranının permeabilitesini artırır ve böylece
kolisinlerin geçişini kolaylaştırır. Buna bağlı olarak diğer moleküllerin içeri
ve dışarı akışı hızlanır ve hücrenin ortamdaki metabolik dengesi bozulur.
Kolisinler, aynı zamanda, bakteri hücre membranında bulunan kolisin reseptörlerine tutunarak etkili
olabilmektedirler. Colicin-B, E, K ve -M
reseptörleri, ferri enterocholin, Vit B12, nukleosid ve ferrichrome (sıra ile)
moleküllerinin hücreye girişinde rol oynarlar. Kolisin reseptörleri kolisinin
aktivitesi için önemlidir. Eğer hücre duvarı ve buna bağlı reseptörler
giderilirse, orijinal hücre kolisine rezistans olsa bile, elde edilen sferoplastlar
duyarlılık gösterirler. Ekseri
kolisinler (Colicin A, -E1, Ia,
Ib, -K) hücre duvarını kanallar oluşturarak,
iyonların kolayca girip-çıkışına permeable hale getirir. Kolisinle muamele edilmiş
hücrelerden genellikle potasyum (K+) iyonları fazla miktarda dışarı çıkar. Colicin E1 ve -K, hücrelerdeki ATP'ye bağlı
reaksiyonları inhibe ederler (protein ve nukleik asit sentezleri de dahil). Katyonların
hücreden çıkışı, bunların kofaktör olarak rollerine de mani olduğundan
enzimlerin aktivitesini de inhibe eder. Colicin
E2 ile
muamele edilen hücrelerin DNA'ları parçalanır. Ayrıca, Colicin E2 ile temas eden
hücrelerde (bakterilerde) 16SrRNA'nın 3-terminusundan 50 nukleotidin çıkmasına neden
olur ve bu RNA etkisiz hale gelir. Cloacid DF13'de
(E. cloacae DF13 tarafından sentez
edilir) benzer tarzda etkiye sahiptir. Bu kolisinlerin pürifiye formları in vitro olarak
nuklease aktivitesi gösterirler. Col El,
-A, Ia, ve Ib, hücre membranında depolarizasyon meydana
getirerek bakteriyi öldürürler. Col E2 ve
-E3'ün de DNase aktivitesi
bulunmaktadır. Col -M ve Pesticin (Y. pestis tarafından
sentezlenir), hücre duvarında ayrışmalar oluşturarak mikroorganizmaları lize eder.
Pesticin, hücre duvarındaki NAGA ve NAMA molekülleri arasındaki beta-1,4 bağlarını
koparır. Kolisinleri
spesifiye eden plasmidler başlıca iki gruba ayrılmaktadırlar. Grup I Col plasmidleri nonkonjugatif bir
karakter taşımakta ve MA. 5x106 kadardır
(Col El-K30, ve Clo DF13, vs). Grup II Col
plasmidleri ise konjugatif olup MA: 50-80 x 106 civarındadır. Bazıları birden fazla
kolisin sentezi için genetik informasyonlara sahiptir. Bunlar aynı zamanda ilaçlara
dirençlilik genleri de taşımaktadırlar (Col
V, ve Col B, F pilusu
oluştururlar). E.
coli
kültürlerinde,
yaklaşık %0.1 bakteri Col+ bir özellik taşımaktadır. Kolisin sentezi
ancak bir kaç saat sürer. Bazı kolisinlerin de kendi bakterisine etkiledikleri
açıklanmıştır. Bakterilerde,
konjugasyon için pilus formasyonunu kodlamayan nonkonjugatif karakterdeki kolisin
plasmidleri, eğer konakçı bakteri Col I gibi
I pilus oluşturan bir plasmidle super
infekte olduklarında, konjugatif plasmid kendi DNA'sı yanı sıra, diğer plasmidlerin
de transferini ve hatta, kendi konakçısının DNA'sını da aktarabilir. F
piluslarını adsorbe eden fajlarla, I piluslarına bağlanan fajlar (Ifl) farklıdırlar.
I pilusları, Col+ bakteri ile Col I- E.
coli 'ler arasındaki konjugasyonlarda
Col I faktörü alıcıya aktarabilir. Kolisinojenik
plasmidler, bakteri içinde bağımsız olarak replike olabilir ve konakçısı için de
zararlı bir etkiye sahip değildir. Yani sentezlediği kolisinden konakçısı genellikle
etkilenmez. UV-ışınları ve mitomycin C ile bazı kolisinojenik faktörler
(plasmidler), indüklenebilirler. Başlangıçta
(orijinalinde) Col plasmidi taşımayan ve nonkolisinojenik olan bir bakteri, bu faktörü
sonradan alarak Col+ hale gelebilir. E.
coli
'lerin
kolisinojenik olup-olmadıklarını belirlemek için pratikte kullanılan bazı teknikler
bulunmaktadır. Bunlardan birisi de "makrokoloni"
yöntemidir. Bu teknik kısaca şöyledir: Taze E. coli buyyon kültürü, agar besi yerinin
ortasına, 1 cm çapında yer kaplayacak tarzda ekilir. Uygun bir ısıda (37°C) 48 saat
inkube edildikten sonra, kültürün kapağına 1 ml kloroform konarak petri kutusu
tersine çevrilir ve böylece 30 dakika kadar bekletilir. Petri kutusunun kapağı
açılarak kloroformun uçması beklenir (15. dakika). Bundan sonra, bütün kolisinlere
duyarlı olan E. coli K suşunun 24
saatlik buyyon kültüründen 1/100 sulandırılarak bundan petri kutusunu ortasındaki
kültüre kadar gelmemek kaydıyla ekim yapılır ve 37°C 'de 24 saat inkube edilir.
Ekilen suşun ürememesi kolisinin varlığını ortaya koyar. Ekilen suşun, daha ziyade
ortadaki büyük koloniye yakın bölgelerinde inhibisyon oluşur. Aşağıda
bazı önemli bakteriyosinler ve bunları sentezleyen mikroorganizmalar gösterilmiştir.
Ancak bunların hepsi plasmid orijinli olmayıp bazıları kromozomaldır. A)
Gram negatif mikroorganizmalar Aerosin
(A.
aerogenes), Alveisin (B. alvei), Kloasin
(E. cloacae), Kolisin (E. coli)
Pestisin (Y. pestis, Y.
pseudotuberculosis) Piyoin (P. aeruginosa) B)
Gram pozitif mikroorganizmalar Stafilokoksin
(Staphylococcus), Streptokoksin (Streptococcus), Subtilisin (B. subtilis), Seresin (B. cereus), Monosin (L. monocytogenes), Megasin (B. megaterium) Kolisin
grupları ve bazı kolisinler Grup
A(I): E, E1,
E2, E3, K, L, N, S4, X Grup
B (II): B, D,
G, H, I, M,S, V,Q 12.4. Virulens Plasmidleri Patojenik
mikroorganizmalar, kendilerinde bulunan bazı virulens faktörleri (bunlardan biri veya
birkaçı ile birlikte) ile konakçıyı hastalandırırlar ve hatta ölümlerine neden
olabilirler. Ancak, bu etkinlikleri, virulent bakterinin konakçıya yeterince ve uygun
yoldan girmesi ve konakçının genetik ve/veya immunolojik yönden (spesifik antikor
taşımaması) duyarlı olması ile yakından ilişkilidir. Bakteri, ne kadar virulent
olursa olsun, eğer konakçı buna direnç gösteriyorsa, mikroorganizma üreyemez,
infeksiyon veya hastalık oluşturamaz. Bakterilerin
sahip oldukları virulens faktörlerinin bir kısmı da kromozomlarında kodlanmasına
karşın bazıları da plasmid orijinlidir. Plasmidlerce kodlanan başlıca virulens
faktörleri hakkında aşağıda kısa özlü bilgiler verilmektedir. C.
tetani
(nörotoksin), B. anthracis (pOX1 letal toksin ve pOX2 kapsül formasyonu), B. thuringiensis
(kristal toksin, insekt larvaları için toksik) A. tumefaciens (Ti plasmidi,
dikotiledon bitkilerde tümör formasyonu), L. lactis (nisin), S. aureus (eksfoliatif toksin), Y. pestis, Y.
psedotuberculosis, Y. enterocolitica (membran proteinlerini
kodlayan plasmidler). S. sonnei, S. flexneri, S. dysenteriae (dizanteri oluşturan
toksinlerin kodlarını taşıyan plasmidler), insanlardan izole edilen E. coli 'lerde LT ve ST-toksinlerin sentezlerini
spesifiye eden plasmidler (CFA-1, -2, E8775), buzağı ve kuzularda hastalık oluşturan E.
coli 'lere ait K99 antijenleri ile
domuz ishallerinden ayrılan E. coli 'ler
de bulunan K88 ve 987 antijenleri plasmidler tarafından kodlanmaktadırlar. Bazı
virulens faktörleri de kromozomal orijinli oldukları gibi bir kısmı da fajlarla
spesifiye edilirler. Örn, C. diphtheriae 'ye
ait beta fajının kodladığı difteri toksini veya C. botulinum C 'de bulunan fajda aynı tarzda toksin sentezini
spesifiye eder. 12.5. Metabolik Plasmidler Metabolik
aktivite bir çok bakteride kromozomlarda bulunan özel genler tarafından yönetilirler.
Ancak, bazı bakterilerde de metabolizma ile ilgili reaksiyonlar hem kromozomal ve/veya
hem de plasmid orijinli olabilmektedir. 1)
Degradatif plasmidler: P.
putida ve diğer pseudomonaslarda bir çok kimyasal maddeyi ayrıştırabilecek
plasmid kaynaklı enzimlere sahiptirler. Böyle enzimlerin sayısı 10'dan fazlayı
bulmaktadır. Örn., SAL, NAH, ASL
ve TOL plasmidleri, sıra ile salycylate, naphtalene, alkyl benzen sulphonate ve tolueni ayrıştırarak catechola çevrilir ve sonra da plasmidlerce
kodlanan enzimler tarafından acetaldehyde
ve piruvatlara dönüştürülür. Degradatif
plasmidler konjugatif bir özellikte olup molekül ağırlıkları oldukça yüksektir
(50-200 x 106). Bu plasmidler,
genellikle, kompatible bir karaktere
sahiptirler ve büyük plasmidler arasındadırlar. TOL, SAL, OCT
ve NIC plasmidleri de iki veya daha fazla
farklı küçük plasmide ayrılabilirler ve bunlar bağımsız replikasyon orijinine
sahip olduklarından da, transfer edildiklerinde hücre içinde serbest replike
olabilirler. Ancak, bunlar, nonkonjugatif bir özellik gösterirler. TOL ve
NAH gibi plasmidler de geniş bir konakçı spektrumuna sahiptirler ve E. coli 'lere ve pseudomonaslara transfer
edilebilirler. 2)
Diğer metabolik plasmidler: Salmonellalar,
genellikle, Lac-'dirler.
Bazen Lac+ fenotipe dönüşebilirler (S. typhi). Bunları, Lac+
plasmidler gerçekleştirirler. Lac+ plasmidlere, salmonellalar dışında,
serratia, S. lactis ve proteuslarda da tesadüf edilmiştir. Plasmidler, aynı
zamanda, salmonellalarda, sukroz fermentasyonuna da neden olabilirler. E.
coli
'lerde
K88 antijenlerini kodlayan plasmidler, aynı zamanda, rafinozun fermentasyonuna da sebep
olurlar. Bazı raf + plasmidler de H2S üretimini de bakterilere
kazandırabilirler. Plasmid
SCP1 (Streptomyces coelicolor), methylenomycin sentezini kodlayabilmektedir.
Kasugamycin ve chloramphenicol da plasmidler tarafından spesifiye edilirler. Rizobiumlarda
bulunan plasmidler de legumine bitki
köklerine nitrojen fikzasyonunda etkin fonksiyonlara sahiptirler. 12.6. Büyük Plasmidler Patojenik
ve nonpatojenik bakterilerde molekül ağırlıkları 1-600 magadalton (Md) arasında
değişebilen plasmidlerin varlığı belirlenmiş, bunların bir kısmının da
moleküler yapıları ve kodladıkları spesifik proteinlerin karakterleri
saptanmıştır. Genel bir kural olmamakla beraber, molekül ağırlığı 50 Md'den fazla
olanlar "büyük plasmidler"
olarak dikkate alınmaktadırlar. Taşıdıkları
çok değişik ve spesifik markerler yanı sıra, rekombinant DNA teknolojisinde de,
özellikle, gen aktarmalarında önemli fonksiyonları olan plasmidlere, daha ziyade kirli
ve organik materyallerden zengin sularda yaşayan bakterilerde rastlanılmaktadır. Bakterilerin
tek ve aynı zamanda küçük kromozoma sahip olmaları bunların genetik potansiyellerini
ve diğer bazı fonksiyonlarını, ökaryotiklere oranla, daha kısıtlamaktadır. Ancak,
bakteri genomlarında meydana gelen çeşitli mutasyonlar ve buna ilaveten, bakterilerde
bulunan ve çok değişik karakterler taşıyan büyük
plasmidler, fajlar, transposon ve İs elementleri, bakterilere yeni sekanslar,
genler ve bunlara bağlı olarak yeni özellikler kazandırmaktadırlar. Fakat, bu
genlerin bazıları, fazla sayıda meydana gelen replikasyonlar sırasında veya
indüktörlerin etkisi altında, bakterilerden ayrılmakta ve mikroorganizmalar orijinal
parental fenotipik karakterlerine tekrar dönmektedirler. Bakteri
kromozomunun %3-5'i uzunluğuna kadar ulaşabilen büyük plasmidler, hücre içinde,
genellikle, küçük plasmidlere oranla daha az sayıdadırlar (1-5 adet). Kointegrasyon
sonunda sayıları daha da azalmaktadır.
Plasmidler, hücre içinde ya bağımsız replikonlar halinde bulunurlar veya
birbirleriyle birleşerek (kointegrasyon) büyük plasmidleri meydana getirirler.
Ancak, bunun anlamı, her zaman böyle olur manasını taşımaz. Bazen de, tersi
olabilmektedir. Yani, büyük plasmidler, daha küçük replikonlara ayrılmaktadırlar.
Kointegrasyon sonucu oluşan multimerik
plasmidler etkinlik bakımından diğerlerine oranla daha fazla avantajlıdırlar.
Hatta, bazılarında da, birden fazla
replikasyon orijini bulunmaktadır. Ancak, replikasyonda sadece bunlardan biri
fonksiyonel olmaktadır. Bakteri
sitoplasmasında bağımsız bir replikon olarak bulunan plasmidler, genomla da
birleşebilirler ve bunun bir devamı haline gelebilirler. Bazı
durumlarda da plasmidlerle kromozom arasında biyokimyasal yönden bir işbirliği de
gelişmektedir. Şöyle ki, bir kimyasal maddenin metabolize olmasında önce kromozom
(veya plasmid) etkinlik göstermekte ve oluşan ürünler de plasmid (veya kromozom)
tarafından son ürünlere kadar ayrıştırılmaktadır. Örn, P. putida da
bulanan CAM (campher) plasmidi (200 Md),
campherin ayrışmasının bir bölümünü, bakteri kromozomu da geri kalan kısmını
tamamlar. P. oleovorans 'da bulunan
OCT (octane) plasmidi (200 Md), alkanları kullanma kapasitesini spesifiye eder.
Ancak, tam olarak, alkanları yağ asitlerine kadar ayrıştıramaz. İlk basamakta,
alkane oksidasyonu plasmid tarafından yönetilir. İkinci aşamada ise, alkol
dehidrasyonu, bağımsız olarak hem plasmid ve hem de kromozom tarafından spesifiye
edilir. Agrobacterium tumefaciens, ornitini
iki ayrı basamakta ayrıştırır. Bunlardan biri pTiC58 plasmidinde kodlanmıştır ve diğeri
ise kromozomal orijinlidir. Kromozom-plasmid işbirliğine (interaksiyon) TOL (toluene) plasmidinde de rastlanılmıştır. Bazı
durumlarda da işbirliği ters veya olumsuz bir yönde gelişebilmektedir. Şöyle ki, Rhizobium
leguminosarum (sym plasmidi, pRIJI) ve R. trifoli 'de
(pRtr5a) bulunan plasmidler,
bakterilerin bakteriosin sentezlerini inhibe ederler. Aynı
fonksiyona sahip plasmidlerin molekül ağırlıkları, değişik bakterilerde, farklı
ölçülerde olabilmektedir. Örn, E. coli
'de laktoz fermantasyonu 58.5 Md'luk plasmid tarafından yönetilmesine karşın, K.
pneumoniae 'de 163 Md'luk plasmid
aynı fonksiyonu yapar. R. leguminosarum
'da bulunan 100 Md'luk plasmid, hidrogenase aktivitesini spesifiye etmesine
karşın A. eutrophus 'da 300
Md'luk plasmid aynı aktiviteyi iki enzimle yapar. Bezende,
aynı aktivite, aynı tür içindeki suşlar arasında değişik molekül
ağırlığındaki plasmidler tarafından, spesifiye edilebilmektedir. Örn, B.
thuringiensis suşlarında insektisidal delta tonsinini kodlayan
plasmidlerin molekül ağırlıkları 44;50 ve 75 Md arasında bulunmaktadır.
Halobacterium suşları arasında da gaz
vakuollerini kodlayan plasmidlerin molekül ağırlıkları 44 ve 100 Md'
arasıdır. Kromozomla
birleşen plasmidler bazı nedenlerle genomdan ayrılabilir ve ayrılırken de kromozomdan
bir segment alabilirler. Böyle plasmidler de sitoplasmada sirküler forma
dönüştürülerek bağımsız olarak kalabilecekleri gibi konakçıdan da
çıkabilirler. Bazı
plasmidler de bir bakteride tek bir ünite halinde bulunduğu halde, diğer bir bakteri de
iki plasmid halinde olabilmektedir. Örn, E. coli 'deki RI ve NR1 plasmidleri, P. mirabilis'e
transfer edilirse küçük replikonlara ayrılmaktadır. P. rettgeri 'den izole edilen R
plasmidi 'R 394, 115 Md) iki plasmide ayrılabilmektedir (11 ve 102 Md). Bunlardan her
biri ayrı bir rezistanslık genini kodlarlar. E.
coli
'de
bulunan R plasmidi tek bir ünite halinde ancak iki
kısımdan oluşmakta (RF ve TF). Proteus
veya salmonellalar da iki replikona ayrılabilmektedir. P.
mirabilis
'teki
rezistenslik plasmidi (NRI) kloramfenikollu ortamda üretilirse, NR1'in büyüklüğünde
ve r-determinant sayısında artmalar meydana gelmektedir. Benzer olguya, tetrasiklin
plasmidine sahip olan S. faecalis 'te
de rastlanılmıştır. Bakteri
içinde iken inkompatible olan iki plasmid, birleştiklerinde (kointegrasyon) bir arada uzun sürü bulunabilmektedirler. Örn,
UV-ışınları ve uygun seleksiyon yöntemleri CAM
ve OCT plasmidlerini kointegre hale
getirebilmektedir. Kointegrasyon aynı zamanda, nontransmissible (nonkonjugatif) olan plasmidlerin mobilizasyonuna yardımcı olduğu gibi, bazılarının da kromozomla birleşmesine veya genomdan ayrılmasına da yol açabilmektedir.
İn
vitro hazırlanan plasmidler, (suni plasmidler)
bakterilere aktarıldıktan sonra hücre içinde bazı yapısal değişikliklere maruz
kalmaktadırlar. 13. Antimikrobiyallere
ve Metallere Dirençlilikte Plasmidlerin Rolü Bakterilerde
bulunan plasmidler kendi konakçılarını, bir çok tarzda, çeşitli antimikrobiyallere
karşı dirençli hale getirebilirler. Plasmidler aracılığı ile gerçekleştirilen
rezistenslik mekanizması başlıca 4 temel grupta toplanabilir. 1)
Antibiyotiklerin etkilediği hedef bölgelerin modifikasyonu, 2)
Antibiyotikler modifiye edilerek etkinliğinin inaktivasyonu, 3)
Antibiyotiklerin hücreye girişinin önlenmesi 4)
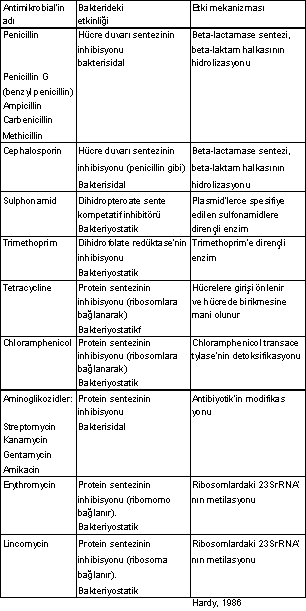
Enzim substitusyonu 13.1 Hedef Bölgenin Modifikasyonu Stafilokok
ve streptokok türlerinde bulunan plasmidlerin kodladığı enzimler, bakteriyel
ribosomlardaki 23S rRNA da bulunan iki adenin molekülünü metile ederek, lincomycin ve
erythromycinin bunlara bağlanmasını önlerler. Erythromycini sentezleyen Streptomyces
erythreus 'un 23 S rRNA'sı dimetile olduğundan,
kendinin sentezlediği antibiyotikten
etkilenmez. 13.2. Antibiyotiklerin Modifikasyonu Bazı
Gram pozitif ve negatif mikroorganizmalarda bulunan plasmidlerce kodlanan kloramfenikol asetiltransferase enzimi,
kloramfenikolu detoksifiye ederek (3-acetoxychloramphenical formasyonunun katalizasyonu)
antibiyotik etkinliğinin inaktivasyonuna sebep olur. Bu
tarzda etkileyen birçok enzim elde edilmiş ve amino asit sekansları da saptanmıştır.
Gram pozitif ve negatifler tarafından sentezlenen enzimler arasında bir yakınlık
vardır. Kloramfenikol asetiltransferase intrasellüler bir enzimdir. E. coli 'de yapısal bir özellik taşıyan enzim, S.
aureus 'ta indüklenebilir
niteliktedir. S.
aureus
'un
birçok suşları penicilin G'ye ve cephalosporine karşı gösterdiği dirençlilik, bu
mikroorganizmalarda bulunan plasmidlerin kodladığı beta-lactamase (penicillinase) enziminin,
antibiyotiklerin yapısındaki beta-laktam halkasını hidrolize ederek ayrıştırması
ve buna bağlı olarak penisilinin etkinliğinin inaktive olmasındandır. Beta-lactamase
enzimi aynı zamanda bazı Gram negatif ve pozitif diğer bazı mikroplar tarafından da
sentezlenir. Ancak, bunların bazıları kromozomal orijinli ve bir kısmı da
plasmidlerce spesifiye edilirler. Bazı suşlarda da her iki tarzda enzim sentezine
rastlanmaktadır. Gram pozitiflerce oluşturulan
beta-lactamase ekseriye ekstrasellüler ve indüklenebilir bir özelliktedir. Aminoglikozidlere
(streptomycin, spectinomycin, kanamycin, gentamycin, amikacin) karşı dirençlilikler de
plasmidler tarafından spesifiye edilen ve antibiyotikleri modifiye eden özel enzimlerin
rolü fazladır. Modifiye olan antibiyotikler ribosomlara bağlanamazlar.
Aminoglikozidleri modifiye eden plasmid orijinli ezimlere, Gram negatif ve pozitif mikroorganizmalarda da rastlanmaktadır.
Bunlar, N-asetilasyon, O-fosforilasyon ve O-nukleotidilasyon meydana getirirler.
Asetilasyon yapan enzimler, kofaktör olarak asetil koenzim A'yı, fosforilasyon ve
nukleotidilasyon yapan enzimler de ATP'yi veya diğer nukleotidleri substrat olarak
kullanırlar. Bu enzimlerin katalize ettikleri reaksiyonlar, aminoglikozidlerde bulunan
birçok amino veya hidroksil grupların birinde meydana gelebilir. Şimdiye dek 12 kadar
farklı etkide enzim saptanmıştır. Bu enzimler, Gram negatiflerin hücre duvarlarında
bulunurlar. 13.3. Antibiyotiklerin Girişinin Önlenmesi Enterobakterilerde
rastlanan Tn10 (Transposon 10) tetrasiklinlere dirençlilikte önemli fonksiyona sahiptir.
Plasmidlerin sağladığı rezistenslikte tetrasiklinlerin hücreye girişi önlenir ve
dışarı atılır. 13.4. Enzim Substitusyonu Sulfonamidler,
dihidroptoreate sentezinde fonksiyonu olan enzimin kompetatif inhibitörleridirler. Bu
enzim (dihidroptoreate sentase), dihidrofolatın sentezi için gereklidir. Bazı
Gram negatiflerde bulunan plasmidler, dihidrofolate sentase enziminin kodlarına
sahiptirler. Ancak, plasmidlerin spesifiye ettikleri bu enzim sulfonamidlere, parental
enzimden, 1000 defa daha az duyarlıdır. Böylece, sulfonamidlerden pek fazla etkilenmez
ve bakterileri de bu antimikrobial ajanın etkisinden korurlar. Trimethoprimler
de, folate metabolizmasında rolü olan diğer bir enzimi, dihidrofolate reduktazın
aktivitesini inhibe ederler. Gram negatiflerde bulunan plasmidlerin kodladığı dihidrofolate reduktase enzimi, kromozomal olan enzimden,
20000 defa daha fazla trimethoprime dirençlidir. Plasmidlerin kodladığı enzimin
molekül ağırlığı 35 000 olmasına karşın E. coli 'nin kromozomal orijinli olan aynı enziminki
ise 20 000 civarındadır. 13.5. Metallere Dirençlilik Enterobakterilerde
ve stafilokoklarda bazı metal iyonlarına karşı dirençlilik, plasmidlerce kodlanan
özel genler tarafından sağlanmaktadır. Enterobakterilerdeki plasmidler, arsenik, gümüş, bakır, cıva ve tellurium iyonlarına, stafilokoklardaki plasmidler, arsenik, bizmut, kadmium, bakır, kurşun,
civa ve çinko bileşiklerine, Pseudomonaslardaki
plasmidler de krom, civa ve tellurium iyonlarına karşı dirençlilik mekanizması
oluştururlar. Bazı iyonlara, özellikle Hg++, Ag+ veya TeO2 karşı rezistenslik, plasmidler sayesinde
100 kat daha fazla artar. Enterobakterilerdeki
konjugatif R plasmidlerinin %25'inde ve Pseudomonas aeruginosa 'daki R plasmidlerinin de %75'inde civa (Hg++)
iyonlarına karşı dirençlilik genleri vardır. Bu bakterilerde bulunan ve plasmidlerce
kodlanan redüktase enzimi Hg++ 'yı
volatile HgO haline redükte eder ve etkisini giderir. Suda erimeyen ve uçucu olan
volatile Hg, civaya dirençli bir bakteri sıvı kültüründen kolayca dışarı
çıkabilir. Tn501,
bakterileri civa iyonlarına dirençli hale getirir. Kadmium ve arsenatlara karşı da plasmidlerce tayin edilen
bir "dışarı itiş" mekanizması
vardır. Gümüş
nitrat tedavisi görenlerden izole edilen enterobakterilerde ve P. aeruginosa 'da, veya diyetlerine büyüme promotoru olarak
bakır katılan hayvanlardan izole edilen
enterobakterilerde bu maddelere karşı dirençlilikte rolleri olan plasmidler
saptanmıştır. 14.
Rekombinant DNA Teknolojisinde
Plasmidler Son
yıllarda, plasmidler, genleri, veya DNA sekanslarını klonlamada aracı molekül (vektör) olarak çok fazla
kullanılmaktadırlar. Çok sayıda, ucuz ve
kolay elde edilmeleri, çift iplikçikli, sarmal, sirküler veya lineer olmaları,
yapılarında seleksiyonda önemli olabilecek bazı spesifik markerlerin (Ampr, Tetr, Kanr,
Lac, vs) bulunması, belli uzunluktaki
yabancı genleri kabul etmeleri, infeksiyöz olmamaları, replikasyon orijinlerine sahip
olmaları, bazı restriksiyon enzimleri için kendilerinde sadece bir kesim yerinin
bulunması, hücre içinde bağımsız replike olabilmeleri, alıcı hücrelere kolayca
transfer edilebilmeleri ve bunun gibi diğer avantajları nedeniyle plasmidler vektör
olarak fazla yararlanılan bir molekül haline gelmiştir.
Plasmidlerin
DNA'larında bulunan markerler, bunların hücre içindeki replikasyonları için pek
önemli değildirler. Bunlar olmadan da plasmidler bakteri içinde bağımsız olarak
dublike olabilirler. Ancak, bunlar, taşıdıkları özel sekanslar nedeniyle
konakçısına bazı önemli karakterler kazandırırlar. İşte plasmidlerde bulunan ve
replikasyonunda gerek duyulmayan böyle bölgelere yabancı genler veya önemli bir
proteinin kodlarını taşıyan sekanslar inserte edilebilir ve rekombinant plasmidler elde edilebilir (hibrid plasmid). Bu plasmid sonradan alıcı
hücrelere (özellikle, E. coli, B. subtilis,
vs) transfer edilerek aktarılan genlerin transkripsiyon
ve translasyonu) sağlanır (ekspresyon). Rekombinant
plasmid elde ederken, plasmidde bulunan özel bir markerin (Ampr, Tetr, Lac, vs) içine
inserte edilen yabancı gen, markerin bütünlüğünü bozduğundan, o genin
inaktivasyonuna neden olur. Bu inaktivasyon, yabancı veya hedef genleri taşıyan bakteri
kolonilerinin seleksiyonunda oldukça fazla yardımda bulunmaktadır. Buna karşın,
diğer genler aktivitesini korurlar. E.
coli
'de
klonlanan gen, burada iki tarzda bir işleme tabi tutulabilir. Bunlardan biri, genin ekspresyonu sağlanarak istenilen gen
ürünü üretilebilir veya genin amplifikasyonu
meydana gelerek çok sayıda gen elde edilir. Plasmidlerin
alıcı hücrelere transferinde ve/veya hücrede iyi bir ekspresyonunu sağlamada suni
(yapay) plasmidlerden fazla yararlanılır.
Bu amaçla, ekspresyon plasmidleri, ekskresyon plasmidleri, mekik vektörler, kosmid, faj
mid, vs gibi prokaryotik ekspresyon vektörleri yanı sıra, plasmid tabanlı
ökaryotik ekspresyon vektörleri de elde edilmiş ve başarı ile kullanılmıştır. Son
yıllarda özel antijen genleri taşıyan rekombinant plasmidler DNA aşılamalarında da kullanılmaktadırlar. Vektörler hakkında ayrıntılı bilgiler "Mikrobiyolojide Biyoteknoloji" adlı bölüm de bildirilmiştir.
[1]
Kaynak: Temel
Mikrobiyoloji |
||||||