|
Bakterilerde Genetik Madde Aktarımı Prof. Dr. Mustafa Arda
Ankara Üniversitesi
Veteriner Fakültesi 01. Giriş 01. Giriş Bakteriler
arasında genetik materyalin (DNA segmentinin kısa veya uzun bir kısmı veya tümü) bir
vericiden (donör) başka bir alıcıya (resipient) transferi, normal koşullar
altında, in vivo veya in vitro olarak kolayca gerçekleşebilmektedir. Aktarılan genler,
eğer bakteriler birbirlerine genetik olarak çok yakınsalar veya DNA sekansları
arasında büyük bir homoloji varsa, alıcının kromozomu ile kolayca
birleşebilmektedirler. Eğer, homoloji çok azsa veya ayrı cinslere ait türler ise bu
birleşme çok daha az oranda olabilmektedir. Burada
iki konuyu birbirinden ayırmada yarar vardır. Yabancı DNA'nın vericiden alıcıya
transfer mekanizması ile, hücre içine giren segmentlerin alıcının kromozomu ile
entegrasyonu farklı olgulardır. Birbirinden ayrı düşünülmesi gerekir. Vericinin
DNA segmentlerinin alıcı bir bakteriye aktarılması ya doğal olarak ve fakat çok az sıklıkla 10-7 - 10-9)
meydana gelebilir veya suni olarak özel teknikler kullanılarak (elektroporasyon, CaPO4 presipitasyon, mikroenjeksiyon, mikroprojektil, vektörler, vs) bu oran yükseltilebilir (10-3 - 10-4)
gibi. Genetik
materyaller sadece bakterilere ve ökaryotiklere ait değildir. Plasmid, faj, virus,
transpozon ve insersiyon sekansları da olabilir ve aktarılabilirler. Bunlara ait
bilgiler kendilerine özgü bahislerde verilmiştir. Gen
transferleri sonunda, alıcı bakteriler, kendi kromozomuna integre olan yabancı DNA
sekansında bulunan genin (veya genler) taşıdığı özel karakterler yönünden pozitif
hale dönüşebilirler. Bakteriler
arasında oluşan bu doğal gen transferi yanı sıra, biyoteknolojik yöntemlerle de (rekombinant DNA
teknolojisi) gen aktarımlarını başarı ile gerçekleştirmek olanak
dahilindedir. Bu teknikte, bir vericide (prokaryotik ve ökaryotik) bulunan ve çok
önemli bir proteinin sentezini kodlayan geni (genleri), restriksiyon endonuklease enzimleri ile keserek
çıkarmak, bir aracı moleküle (vektör) bağlayarak
oluşturulan bu rekombinant vektörü (plasmid,
faj, cosmid, mekik vektörler, virus, bakteri) alıcı bir organizmaya (prokaryotik veya
ökaryotik) transfer etmek ve burada genin
ekspresyonunu sağlamak mümkündür (gen
klonlaması, moleküler klonlama).
Çok yararlar sağlayan bu teknoloji hastalıkların teşhis, kontrol ve sağaltımın da
olduğu kadar araştırmalar da da çok büyük katkıları bulunmaktadır. Bakteriler
arasında doğal gen transferleri başlıca
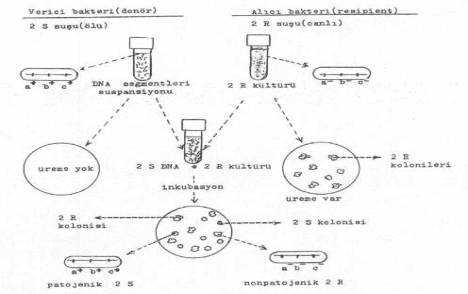
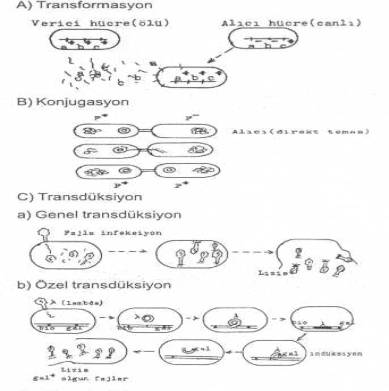
3 mekanizma ile gerçekleşmektedir. 1) Transformasyon 02. Transformasyon Bir
mikroorganizma, kendisine DNA kompozisyonu yönünden çok yakın olan, diğer bir
mikroorganizmaya ait genetik materyal (DNA segmentleri) içeren bir ortamda üretilirse,
belli bir süre sonra, bu sıvı ortamdan katı besi yerine ekimler yapılırsa, bazı
kolonilerin değişik morfolojide olduğu ve bunların, genetik materyali veren ölü
mikroorganizmanın orijinal kolonilerine benzediği görülür. Örn, D. pneumoniae
'nin II-R suşu, kendisini oluşturan II-S suşundan ekstre edilen DNA materyalini ihtiva
eden uygun bir sıvı ortamda ve uygun bir süre temasa bırakıldıktan sonra, katı besi
yerine yapılan ekimlerde bazı kolonilerin II-S karakterinde olduğu görülür. Bu
denemede, II-S suşu öldürülmüş ve elde edilen DNA ekstraktları ortama
katılmıştır. Canlı olan II-R suşu ortamda bulunan II-S suşuna ait bazı genetik
materyalleri almış ve bu elementlerde taşınan karakterler yönünden pozitif hale
gelmiştir (II-S haline dönüşmüştür).
Yukarıda
bildirilen in vitro transformasyon, aynı şekilde, in vivo olarak ta oluşturulabilir.
İn vivo transformasyon, Griffith'in deneyi
ile gösterilebilir. Farelere, önce virulent ve kapsüllü olan II-S suşundan mutasyonla
elde edilen canlı II-R suşu (avirulent ve kapsülsüz) verilir. Bunun arkasından, ısı
ile öldürülmüş olan II-S suşundan fazla miktarda şırınga edilir (aslında II-R
suşu pneumonia oluşturmadığı gibi, II-S 'de öldürülmüş olduğu için infeksiyöz
yeteneği yoktur). Ancak, deneme sonunda ölen farelerden katı besi yerine yapılan
ekimlerde, üreyen koloniler arasında, bazılarının II-S karakterinde (kapsüllü ve
virulent) oldukları görülür. Bu durum, aynı in vitro deneyde olduğu gibi, II-R
suşları, fare vücudunda, II-S 'lere ait bazı genetik materyalleri almış ve II-S
karakterine dönüşmüş ve fareleri öldürmüştür. Bu iki
(in vivo ve in vitro) denemede, ortak olan nokta, verici hücre (bakteri) DNA
parçacıklarının alıcı hücre (bakteri) kromozomu ile birleşmiş olması ve verici
hücreye ait karakterleri yönünden alıcıda pozitifliğin elde edilmesidir. Her iki
hücrenin de antijenik yakınlığının çok fazla olması (birbirinden mutasyon ile
türemiş olmaları) gen alışını kolaylaştırmaktadır. Antijenik yakınlığı
olmayan bakteriler arasında transformasyon, genellikle, nadirdir. Bir
DNA segmentinin, diğer bir bakteri kromozomu ile birleşebilmesi için, her ikisinde de
baz sıraları bakımından bir homologluğun olması şarttır. Bu nedenle, birleşebilen
ve birbirinin komplementleri olabilen bu bölge ile DNA parçacıklarındaki A+ T/G + C
oranının aynı veya birbirine çok yakın olması da gereklidir. Bu takdirde, verici
hücre DNA segmenti, kendine homolog olan, alıcı hücre DNA'sının özel bölgesiyle
ilişki kurar ve buradan birleşebilirler (integrasyon).
Bazı durumlarda, verici hücre DNA'sı alıcı hücreye girse bile özel alıcı
bölgeler (homolog yanlar) olmadığı sürece birleşme olamaz. Homolog rekombinasyonun
meydana geldiği durumlarda, verici hücre DNA parçacığı, alıcının kromozomunun bir
parçası veya devamı haline gelir. Bununla birlikte replike olur ve hücrenin
bölünmesi sırasında da bir kopyayı diğer kardeş hücreye aktarılır. Transformasyonda,
alıcı ve verici (donör) hücrelerin DNA'larının homolog oluşları yanı sıra bazı
önemli faktörlerin de etkisi bulunmaktadır. Uygun
ortam ve optimal koşullarda, üreyen hücrelerden ancak 10-7-10-8 kadarının, DNA segmenti alma yeteneği vardır. Bu
nedenle üreme sırasında bazı hücrelerin belli bir fizyolojik duruma ulaşmasının ve
DNA parçasını alabilecek kabiliyete (permeabiliteye)
kavuşmasının da önemi fazladır. Diğer bir deyimle alıcı hücrenin diğerlerinden
farklı ve kompetent olması gereklidir.
Diğer önemli noktalardan biri de, DNA segmentlerinin, 0.3-8 x 105 dalton molekül ağırlığından aşağı
olmaması durumudur. Çift iplikçikli olmayan ve yukarıda bildirilen ölçülerden
küçük olanlar alıcı hücrelere kolayca giremezler. Alıcı
hücrenin yüzeyi, verici hücrenin DNA parçacığının adsorpsiyonu için
önemlidir. Alıcı hücre yüzeyinde özel ve belli alıcı bölgeler (reseptörler) bulunmaktadır. Kapsüllü
bakterilerde adsorpsiyon ve içeri giriş olgusu çok zordur. Yapılan çalışmalar,
bazı bakterilerde 75 kadar böyle özel alıcı adsorpsiyon bölgesinin bulunduğunu
ortaya koymuştur. Kapsülün bulunmadığı ve diğer koşulların uygun olduğu
durumlarda, adsorpsiyon gerçekleşebilir. Hücre yüzeyine adsorbe edilen DNA segmenti,
eğer içeri girme fırsatını bulamaz veya girmede gecikirse tuz, pH ve
deoksiribonuklease (endonuklease)
tarafından etkisiz hale getirilir veya lize edilir. Bu etkilerden kurtulabilenler içeri
girerler (penetrasyon). Yukarıda bildirilen engeller,
bakteriler için bir korunma veya bir sınırlama mekanizmasıdır. Verici hücre
DNA'sının çift iplikçikli olması rekombinasyon bakımından önemlidir. Ancak, bazen
alıcı hücre DNA'sı ile sadece bir iplikçik birleşir, diğeri endonuklease
tarafından lize edilir. Birleşen iplikçiğin karşısında, alıcı hücre, hemen
komplementerini sentezler. Böylece birleşme bölgesi çift iplikçik haline
dönüştürülür (rekombinasyon). DNA
segmenti alıcı hücre yüzeyindeki özel bölgelere adsorbe olduktan ve içeri girdikten
sonra, bakteri türleri arasında değişiklik göstermek üzere, 10 dakika ile birkaç
saat süre içinde kompetent hücre DNA'sı ile birleşme olur. Aradan geçen bu süreye eklips (latent) dönem
adı verilir. Hücreye giren DNA segmenti
çift iplikçik halinde kalabilir ve sirküler forma dönüştürüldükten sonra
alıcının DNA'sı ile de birleşebilir. Ekzogenotun
alıcı hücre DNA'sındaki özel komplementer bölgeyle yan yana gelmesi gereklidir. Buda
sağlandıktan sonra, ekzogenot ile endogenot arasında homolog rekombinasyon
gerçekleştirilir. Oluşan hibrid DNA'nın uçları ligase enzimi aracılığıyla
birleştirilerek rekombinasyon tamamlanır.
Böylece integre olan ekzogenot alıcı hücrenin DNA'sının bir parçası ve devamı
haline gelir ve birlikte replike olur. Ancak, alınan karakterlerin yeni nesillerde
görülebilmesi için 2-3 generasyonun geçmesi gereklidir. Adsorpsiyon
olayı geriye dönüştürülebilir. Eğer, alıcı hücre yüzeyindeki reseptörler
(alıcı bölgeler) tripsinle veya DNA parçacıkları DNase ile muamele edilirse
adsorpsiyon gerçekleşemez. İçeri girdikten ve integrasyon olduktan sonra artık DNase
etkilemez. Eklips dönemi bakteriler arasında değişiktir. H. influenzae de bu süre çok kısadır.
Bazı bakterilerde ise birkaç saat uzayabilir. D.
pneumoniae 'den
başka H. influenzae, stafilokok, bitki patojenleri, basiller, nitrojeni fikse eden
mikroorganizmalar arasında da, transformasyon tespit edilmiştir. Enterobakteriler arasında transformasyon pek
başarılı olmamakla beraber, son yıllarda, yüksek kalsiyum iyonları
konsantrasyonlarında E. coli 'de
de transformasyon saptanmış olduğu bildirilmektedir. Transformasyonla,
verici bakterilere bazı özel karakterler aktarılabilmiştir. Bunlar arasında laktoz ve
galaktoz pozitif genler, antibakteriyel maddelere karşı dirençlik, virulens, v.s.
sayılabilir. Bu faktörler alıcının DNA'sı ile birleştikten sonra, transkripte
olarak mRNA'ya aktarılır ve buradan da transle edilerek, hücrede yeni karakterlerin
ortaya çıkmasına neden olurlar. Transformasyondan
yararlanarak bakterilerin kromozom haritaları çıkarılabilir. Bu teknikle elde edilen
haritaların yardımıyla gen sıraları, genlerin birbirine uzaklıkları ve birbirlerine
olan ilişki durumları öğrenilebilir. Ancak, en iyi haritalar konjugasyon ve
transdüksiyon ile yapılmaktadır. Transfeksiyon:
Virus,
plasmid, faj, bakterilerin ve DNA segmentlerinin kompetent hücrelere özel yöntemlerle
aktarılması olayına transfeksiyon adı
verilir. Örn, bakteride sentez edilen fajlardan bazıları kapsid taşımayabilir veya
faj DNA'sı sentezlendikten sonra kapsidle birleşmeyebilir. Bakteri lize olduktan sonra
serbest kalan bu fajlar ortamda hazır bulunan kompetent hücreler tarafından
alınabilirler. Ancak, bu olay çok sınırlı ve nadirdir. E. coli K12'de ve sferoplastlarda transfeksiyona
rastlandığı bildirilmiştir. Hücrelere
DNA segmentinin fazlaca girmesini kolaylaştırmak için, CaPO4'la presipitasyon, mikroenjeksiyon,
elektroporasyon, vs özel tekniklerden yararlanılır. 03.
Konjugasyon Konjugasyon,
verici hücre DNA'sının tümünün veya bir segmentinin, ya bu iki hücrenin direkt teması veya seks pilusları aracılığı ile alıcıya
aktarılması olayına verilen bir isimdir. Bakterilerde konjugasyon olgusunu aydınlatan
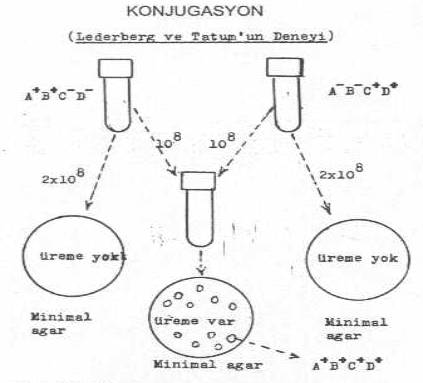
ilk çalışmalar, J. Lederberg ve E.L. Tatum'un (1946) araştırmalarından
kaynaklanmaktadır. Araştırıcılar, iki amino asit ekzotrofik karakteri taşıyan 2 E.
coli K-12 mutantı üzerinde
yaptıkları çalışmalar ile konjugasyona açıklık kazandırmışlardır. Bu denemede,
biri, amino asit A- ve B- için okzotrofik, fakat C+ ve D+
amino asitleri sentezleyebilen (A-B-C+D+), diğeri ise bunun tersi olan (A+B+C-D-) iki
mutant suş bir besi yerinde karıştırarak bir süre (6-7 saat) inkubasyonda tuttuktan
sonra (bu aminoasitleri içermeyen) minimal besi yerine ekilmiştir. Bu iki suş ayrı
ayrı bu besi yerlerinde ürememelerine karşın, birlikte olduktan sonra ekildiklerinde
bazı kolonilerin meydana geldiği ve bu kolonilerdeki E. coli 'ler incelendiğinde 4 amino asit yönünden de
(A+B+C+D+) pozitif oldukları görülmüştür. Ancak bu
olgu 10-6 kadardır.
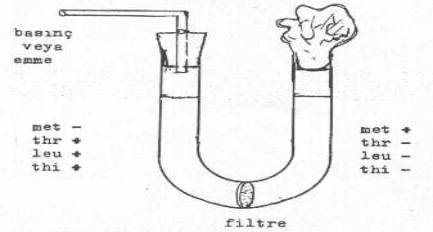
B.Davis
(1950)
U-tüpü kullanılarak yaptığı bir çalışmada konjugasyon için direkt temasın
gerekli olduğunu ortaya koymuştur. U-tüpünün alt kısmına yerleştirilen ve bakteri
tutan bir filtre ile sadece besi yerinin birbirine geçişi sağlanmasına karşın
bakterilerin geçişi önlenmiştir. Tüpün içine minimal besi yeri konduktan sonra, bir
yarımına met+, thr,- leu-,
thi- ve
diğer yarımına da met-, thr+, leu+, thi+ E.
coli mutant suşları ekilmiş ve 4 saat inkubasyonda tutulduktan sonra minimal
besi yerlerine ekildiğinde hiçbir koloninin oluşmadığı gözlemlenmiştir. Bu durum
gen aktarımda direkt temasın önemli
olduğu ortaya koymaktadır. Lederberg
ve Tatum'un denemelerinde direkt temas üzerinde
durmamışlardır. Davis, bu çalışması ile direkt temasın konjugasyonda çok önemli
faktör olduğunu ortaya koymuştur.
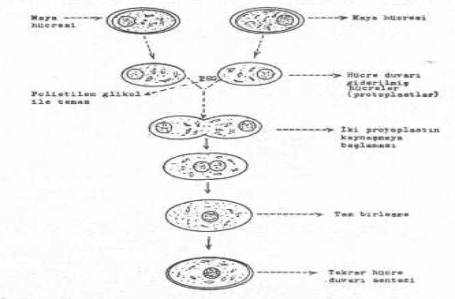
Protoplast
füsyon tekniği de
(bakteri, basil, streptomyces, maya, bitki, vs.) gen aktarımı için kullanılmaktadır. İki
ayrı türe ait protoplastlar elde edildikten sonra, bunlar, PEG'lu ortamda direkt temasa
getirilirler. Uygun bir süre ve ısıda tutulan protoplastlar arasında birleşme ve gen aktarmaları kolayca
olabilmektedir.
Konjugasyon
fenomeninde, verici durumda olma kabiliyetini, genellikle, hücrede bulunan ve
nakledilebilir bir genetik element olan plasmidler tayin ederler. Bu plasmide fertilite faktörü (F-faktörü veya seks faktörü) adı verilir. Bu faktörü alan
hücreler taşınan karakterler yönünden pozitif hale gelirler. Aktarma olayı 10-5-10-6
oranında meydana gelmektedir. İki
hücre arasında konjugasyonun gerçekleşebilmesi için, bunların birbirleriyle temasa
gelmesi gerekir. Bu olguyu, direkt temas kadar,
genellikle, verici hücrelerdeki seks pilusları
da yaparlar. Seks piluslarının sentezlenmesini hücre içinde bulunan seks
faktöründeki özel genler sağlarlar. Bunlar, diğer normal piluslardan (fimbria) daha uzun ve kalındırlar. Ortaları
boş olduğundan bir boru ve geçit köprüsü görevini yaparlar. Genetik materyal
buradan geçerek alıcıya aktarılır. Normal pilusların gen aktarmasında rolleri
yoktur. Konjugasyonla
aktarılabilen birçok ekstra kromozomal genetik
element bulunmaktadır. Bunlar arasında başlıca, virulens faktörleri, fertilite faktörü
(F-faktörü), dirençlilik faktörleri
(R-faktörleri) ve kolisin faktörü (Col-faktörü) en önemlileri
arasındadır. F
faktörü ihtiva eden hücrelerde bu faktörün kromozom üzerinde olması çok
önemlidir. Ancak, böyle hücreler (Hfr, high frequency recombination) yüksek sıklıkta genetik
materyallerini aktarabilirler. Kendisinde F faktörü olan, ancak bunu kromozomu üzerinde
taşımayan hücrelerde (F+) genetik
materyali aktarma oranı daha düşüktür. Bir
bakteride bulunan F faktörü, yalnız kendini değil aynı zamanda içinde bulunduğu
hücrenin DNA'sının da aktarılmasını stimule eder. Bu nedenle, F faktörünün
girdiği hücre, bu faktörü aktarmak için hemen reorganizasyona geçer ve seks pilusu
sentezlemeye başlar. Normal piluslardan daha kalın, büyük ve ortası boş olan seks
piluslarının sentezi kısa bir zamanda tamamlanır. Bu piluslar mekanik olarak
giderilirse konjugasyon gerçekleşemez. Kopan veya koparılan seks pilusları kısa bir
süre içinde (20-30 dakika) tekrar sentezlenirler. Bu sentez mekanizmasını, seks
faktöründe bulunan özel genler yönetirler. Bu piluslar 7 nm. çapında olup aynen bir
bakteriyofaj kuyruğu gibi görev yaparlar. Molekül
ağırlığı 1200 kadar olan ve tek bir protein molekülünden oluşan bu piluslar, ancak
elektron mikroskopla veya özel antikor teknikleriyle ortaya konabilirler. F
faktörü sirküler, çift iplikçikli DNA segmenti olup (plasmid) moleküler
ağırlığı 35 x 106 ve uzunluğu
da 32 nm'dir. Bu uzunluk, ortalama bir bakteri DNA'sının %1.2'si kadardır ve takriben
40-60 proteini kodlayabilir. F faktörü sadece bir transfer faktörü olup, diğer
faktörleri (R, Col, v.s.) taşımaz ve kendi varlığını koruyabilecek ve aktarabilecek
genetik bilgilere sahiptir. F
faktörünün stimulasyonu sonu oluşan seks piluslarına özel fajlar adsorbe olurlar. Bu
fajlar başlıca iki tür olup biri küçük, yuvarlak, RNA yapısında (QB ve R17), diğeri ise flamentöz ve DNA
karakterindedir. Bunlardan ilki seks pilusunun yüzeyine, ikincisi ise ucuna adsorbe olur.
Bunlar bazen de piluslardan içeri girerler ve pilusun kanalını tıkayarak konjugasyona
mani olabilirler. Ancak, bu fajlar DNA'larını pilustan içeri enjekte etmezler. Seks
pilusu sadece bir köprü görevi yapmaz, aynı zamanda, F- hücreye bağlanmada da rol alır. Fakat, yapılan
çalışmalar, seks pilusu olmadan da iki bakterinin yan yana gelmesi ve direkt teması
hallerinde gen aktarmasının mümkün olduğunu ortaya koymuştur. Laboratuvarlarda,
konjugasyon oluşturmak için, F+ hücrelerle F- hücreler uygun bir inkübasyon ısısında belli
bir süre aynı yerde bir arada bulundurulurlar. Her şeyin normal gittiği durumlarda
transfer, mikroorganizmanın türüne göre değişmek üzere, konjugasyon 90-140 dakikada
gerçekleşir. Köprüye en yakın bulunan genler en erken köprüye girerek alıcı
bakteriye geçerler. Bir
dakika içinde takriben kromozomun %1'lik segmenti geçebilir ki bu da tüm kromozomun 11
nm'lik bir parçasını (veya iplikçik başına 5x106 nukleotid) oluşturur.
Bu genetik uzunluk yaklaşık 20 rekombinasyon
ünitesine tekâbül eder. Aktarma
sırasında Hfr hücrelerde, F faktörü, hücre DNA'sı ile birleşmiş olduğu yerden
kopmakta ve bu faktör bakteri kromozomunun arka ucunda kalmaktadır. Bu durum, konakçı
DNA'sının aktarılmasında itici bir güç yaratmaktadır. Sonda bulunması nedeniyle,
eğer yeterli süre tanınmazsa veya kültürler çalkalanırsa, F faktörü alıcı
hücreye aktarılamaz. Bu nedenle, Hfr x F-
hücre birleşmelerinde genellikle F- hücreler elde edilir. Buna karşılık F+
x F- hücre birleşmesinde F+ hücreler daha
fazladır. Halbuki, Hfr hücreler, F+'lere oranla, 1000 defa daha fazla
konjugasyon yapma yeteneğine sahiptirler. Hfr hücrelerden F- faktörü alıcıya az oranda geçmesine karşın,
donör DNA segmentinin geçme olanağı çok fazla olduğundan, gen aktarması yüksek
sıklıkta gerçekleşebilmektedir. Sirküler
olan F faktörünün, alıcı hücre kromozomu ile birleşebilmesi için birbirlerinde homolog bölgelerin bulunması gereklidir.
Birleşmeden önce sirküler olan F faktörü bakteri kromozomu üzerindeki homolog bölge
yanına gelir. Birleşme homolog bölgeler arasında tek bir krosoverle gerçekleştirilir. Böylece, Hfr
hücreler meydana gelirler. E. coli 'nin
kromozomu üzerinde F- faktörü
için homolog olan birçok bölge (8-10 kadar) bulunmaktadır. F faktörü bu bölgelerin
bir tanesi ile integre olur. Hfr hücre oluştuktan sonra, bu faktör hücreyi seks pilusu
oluşumu için tembih eder ve sentez mekanizmasını aktive eder. Konjugasyon
transferinden yararlanılarak bakteri kromozomunun
gen haritası çıkarılmaktadır. Örn, Hfr x F-
hücreler birbirleriyle temasa getirildikten sonra belli aralıklarla (her dakika
veya iki dakikada bir) karışım çalkalanılarak gen transferine mani olunur veya
kromozom koparılır. Buradan
yapılan ekimlerden meydana gelen koloniler aktarılabilen karakterler yönünden
incelenirler. Böylece, dakika dakika, geçen kromozom segmentleri üzerindeki genlerin
türü, sırası, birbirine olan ilişkisi ve uzaklığı saptanır. Yapılan
çalışmalarda Hfr x P46 hücreleri ilk 5 dakika içinde prolin (pro+) sentezini idare
eden genleri transfer etmekte, bunu 12 dakika sonra threonin (thr+) izlemektedir. Bu ilk
iki gen arasında 7 dakikalık bir zaman dilimi bulunmaktadır. Diğer bir Hfr-H suşu
ise, threonin genini ilk 8 dakika içinde aktarmakta, bundan 15 dakika sonra da prolin
(pro+) geni geçmektedir. Bu son mikroorganizmada da iki gen arasında 7 dakikalık bir
zaman dilimi vardır. Bu iki deneme transfer hızının sabit olduğunu kanıtlamaktadır.
Bütün kromozomun aktarılması için geçen süre, mikroorganizma türüne göre
değişmekte ve E. coli 'de 90, salmonellalar da ise 110-140 dakika
arasındadır. E. coli üzerinde 3x 106
nukleotid çifti bulunmakta ve her dakikaya 3.3x104 nukleotid çifti veya yaklaşık olarak
33 gen isabet etmektedir. Kromozom daima 5'-ucundan alıcı bakteriye geçer ve bir
kopyası daima verici hücrede kalır. Hfr x F-
hücre birleşmesinde ilk geçen faktörler sırasıyla thr, leu,
pro, lac, gal
ve bunun arkasından ve daha yavaş olarak, his, ser,
str, met geçerler. Ancak, her Hfr hücrenin kendine
özgü transfer özelliği vardır ve bu durum DNA'daki kopma yerine göre değişir. Her
Hfr'de kopma yeri farklı olduğundan aktarılan gen sırası da değişebilir. Ancak,
çoğu zaman F faktörü kromozomun sonunda olacak şekilde kopma meydana gelir. Yukarıdaki
örneklerde de görüldüğü üzere, farklı Hfr suşlarında genlerin sırasında
değişiklik bulunmaktadır. Birinde ilk gen prolin iken, diğerinde threonin
olabilmektedir. Genler arasındaki zaman diliminin aynı olması bunların kromozom
üzerinde aynı mesafelerde bulunduğunu gösterir. Ancak, transfer noktaları farklılık
göstermektedir. E.
coli
K 12
suşu, enterobakterilerin diğer türleriyle de (shigella,
salmonella, serratia, proteus, v.s.) konjugasyon yapabildiği saptanmıştır. Ancak,
bu ayrı cinslerle olan konjugasyon, E. coli
türleri arasındakinden 1000 defa daha az sıklıkta olmaktadır. Çünkü, E. coli K 12 ile, S. typhimurium 'un bazı suşları arasındaki homologluk
oranı %45, proteusla %6 ve S. flexneri ile %85 kadardır. Aralarında az çok
homologluk durumunun bulunması nedeniyle konjugasyon olabilmekte ise de, sonunda
integrasyonun olacağı söylenemez. Böyle homolog yanları az olan hücrelerde, F
faktörü hücre içinde serbest halde bulunur (plasmid). Hfr
hücreler geri bir mutasyonla F+ hale
gelebilirler. Böyle durumlarda, kromozomla birleşmiş ve onun bir devamı haline gelmiş
bulunan F+ faktörü, kromozomdan ayrılarak sitoplazmada serbest hale geçer
ve hücre de, bu nedenle, Hfr durumundan F+ hale gelmiş olur. Bu durumu ile F
faktörü, plasmide benzer. Hücre içinde bağımsız olarak bulunan bu faktör, hücre
DNA'sı ile birlikte ve aynı anda (senkronize)
replike olur. Aynı zamanda, sitoplasmik membranda bulunan özel replikasyon bölgesini (mesosom) birlikte kullanırlar. Plasmid haline
dönüşen F faktörü kendi varlığını devam ettirebilecek genetik bilgilere sahiptir.
Hfr hücrelerinin F haline dönüşü (Hfr - F+) 10-5-10-6
oranında meydana gelir. Bazı hallerde F faktörü, konakçı DNA'sı üzerinden ayrılırken, DNA'da yapıştığı bölgeden, konakçının bazı DNA parçacıklarını da alabilir. Bunlar, F faktörünün bir ucunda veya iki ucunda bulunabilirler. Böyle yabancı kromozom parçası ihtiva eden F faktörüne F'-prime faktör (F') ve alıcı hücreye de F' genot adı verilir. F' faktörünü taşıyan hücreler (F' prime), eğer çok önemli biyokimyasal olayları idare eden genleri kaybetmişse hücrenin ölümüne neden olabilir. Eğer, F faktörü, hücre DNA'sında iken galaktoz ve laktoz genlerinden birinin yanında ise, ayrılırken bu genlerden birini beraberinde alarak ekstra kromozomal genetik element haline geçebilir ve sitoplazmada F+-gal+ veya F+ - lak+ durumunda bulunabilir. Eğer bu F+ -gal+ veya F+ - lak+ plasmid başka hücreye (F¯ - gal- veya F-- - lak) transfer edildiğinde o hücreleri gal+ veya lak+ hale dönüştürürler. Böylece, oluşan hücreler sekonder F'-hücreler ve bu olaya da seksdüksiyon adı verilir. Eğer, sekonder F' hücreler, F- hücrelerle birleştirilirse iki tip transfer meydana gelebilir. Bazı hücreler sadece F' genotu, diğer kısmı ise, hem F' genot DNA'yı ve hem de bitişik kromozom DNA'yı transfer edebilirler. Bu ikinci tipte F integre olmuştur. Bazı
durumlarda da F-faktörü konakçı hücreyi terk ederek ayrılabilir ve böylece hücre
F¯ hale gelir (Hfr ® F+ ® F¯).
Diğer bir ifade ile hücreler, plasmidden kurtulabilirler
(iyileşme). Bu olay, eğer F+ hücreler 42°C 'de ve durucu pozisyonda
üretilirse gerçekleştirilebilir. Bazı durumlarda da akridin boyaları, hücre içinde bağımsız
olarak bulunan F faktörünün replikasyonuna mani olmak suretiyle hücreleri F
faktörünün etkisinden kurtarabilir. Bazı olaylarda da Hfr hücrelerinden F faktörü
ayrılırken, F faktöründen bir kısmı alıcı hücre DNA'sında da kalabilir. Yukarıdaki
bilgiler ışığı altında F faktörü bir hücrede başlıca 3 pozisyonda
bulunabilmektedir. Bunlar da: 1-
Bağımsız genetik element (F+), (Plasmid) Bu
durumları ile F faktörü, E. coli nin
lambda (l)
fajına benzemektedir. Bu faj serbest veya virulent faj halinde bulunabileceği (plasmid)
gibi, konakçı DNA'sı ile birleşmiş (profaj) (episom) veya konakçıdan laktoz genini
almış olarak ta bulunabilir (F'prime). 04.
Transdüksiyon Genetik
materyalin verici bir bakteriden alıcı bir bakteriye fajlar aracılığıyla
nakledilmesine transdüksiyon adı verilir. Transdüksiyon suretiyle gen aktarılma
olayına Gram negatif (Salmonella, E. coli, Shigella, Proteus, Vibrio, P. aeruginosa, vs.) ve Gram pozitif
mikroorganizmalarda (Stafilokok ve basiller)
rastlanılmıştır. Fajlar,
bakterileri parçalayan veya lize eden viruslardır (bakteriyofaj). Konakçıya özel olduklarından,
bakteri fajları arasında da tür spesifitesi vardır. Bazı
fajların genomu, konakçı hücresine girdikten sonra orada replike olur ve bakteriyi
parçalar (virulent veya vegetatif fajlar).
Bir kısmı ise, infekte ettiği hücreyi lize etmeyebilir (temperate fajlar). Böyle fajlardan bazıları
sitoplazmada kalır veya bazıları da konakçı DNA'sı ile birleşebilir. Böylece onun
bir devamı haline gelebilir (profaj).
İçerisinde profaj halinde bakteriyofaj bulunduran lizojenik hücreler, ultraviolet ışınlarına
maruz bırakılırsa, profaj aktive olur ve konakçısını lize edebilir. Profajlar,
yerleştikleri konakçı DNA'sından bir veya birkaç gen içeren bir segment parçasını
alabilir ve bunu, adsorbe olduğu başka alıcı hücreye aktarabilir.
Transdüksiyon
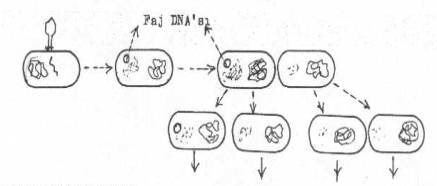
başlıca üç tarzda gerçekleştirilebilmektedir. 04.01. Generalize Transdüksiyon Generalize
transdüksiyonda, bakteri hücresi içinde faj olgunlaşırken, parçalanan konakçı
DNA'sından bir segment, aynı yerde sentezlenen faj kapsidi içine tesadüfen girebilir.
Böylece bu kapsid (fajın baş kısmı içinde), faj DNA'sından ayrı olarak ve
değişik uzunlukta (50-100 gen içerebilir) bakteri DNA'sını da ihtiva etmiş olur.
Böyle bir faj etrafa yayıldıktan sonra, başka bir bakteriyi infekte ettiğinde, kendi
DNA'sı ile birlikte konakçı DNA'sını da alıcı hücreye aktarır. Eğer, faj,
taşıdığı bu bakteri DNA'sı ile birlikte konakçı hücrenin kromozomu ile
birleşirse, taşıdığı karakterler yönünden alıcı hücreyi pozitif hale getirir.
Birkaç krossover dan sonra bakteri DNA'sı ile birleşebilen bu faj + bakteri DNA
segmenti, alıcı hücre kromozomunun bir devamı haline gelir, birlikte replike ve
transkripte olur ve taşıdığı genlerdeki bilgiler aynen mRNA'ya aktarılarak
translasyona iştirak eder. Generalize
transdüksiyonda, bu görevi yapan fajlar, konakçı DNA'sının herhangi bir geninin veya
belli bir segmentinin yanına yapışmazlar. Konakçı DNA parçalandığı zaman hücre
içinde dağınık bir halde bulunan DNA parçacıklarından herhangi birinin, faj kapsidi
içine tesadüfen girmesi ve içinde kalması sonu bu tarzda aktarılma şansına sahip
olabilmektedirler. Bu nedenle her bakteri DNA segmentinin veya bunun üzerinde bulunan
özel karakterlerin (genlerin) taşınma veya alınma olasılığı bütün genler için
eşit olmaktadır. Generalize
transdüksiyon yapabilen fajlar arasında E. coli K 12'nin P1 fajı (M.A. 60 x 106) ve Salmonellalarda
PLT 22 fajı (M.A. 26 x 106) vardır. Bu fajlarla gerçekleştirilebilen
generalize transdüksiyon 10-5-10-6 oranındadır. E. coli K 12-P1 fajı konakçı DNA'sı
ile birleşmez ve bir plasmid gibi hücrede bağımsız kalır ve müstakil olarak replike
olur. Bu faj aracılığı ile, E. coli K
12 suşunun triptofan sentezinde görev yapan 5 genin sıralanması
saptanabilmiştir. Salmonellalardaki PLT
fajının hücreye adsorbe olabilmesi için konakçının somatik O-antijen 12
fraksiyonuna sahip olması gerekir. B. subtilis 'te bulunan SPIO ve
PB 51 fajları da aynı şekilde generalize transdüksiyon yapabilmektedirler.
Ancak, bu fajlar konakçı genomu ile integre olabilirler. 04.02. Özel Transdüksiyon Özel
transdüksiyon oluşturan fajlar konakçı DNA'sında belli bazı genlerin yanına
yerleşirler ve hücre DNA'sı ile birleşerek profaj
haline dönüşürler. Bu bakımdan da, episom karakteri gösteren F-faktörüne
benzerler (Hfr). Konakçı hücrenin kromozomu ile birleşmiş bulunan faj, konakçı
hücre UV-ışınlarına maruz bırakılırsa, aktive olur ve DNA'dan veya yerleştiği
yerden ayrılarak konakçısını lize ederler. DNA'dan ayrılırken, yanında bulunduğu
veya yanına yapıştığı bakteriye ait geni de birlikte alarak ayrılırlar. Böyle bir
faj başka bir bakteri kültürüne inokule edilirse buradaki hücreleri infekte
ettiğinde bu taşıdığı geni o bakteriye aktarır ve bakteriyi, gende bulunan özel
karakterler yönünden, pozitif hale getirir. Özel
transdüksiyon yapan fajlar arasında E. coli K 12 'nin lâmbda fajı ve Ø 80 fajı örnek olarak gösterilebilir.
Lâmbda fajı, E. coli 'de
genellikle biotin ile galaktoz geninin arasına girer ve burada profaj
olarak bulunur. Hücreden ayrılırken galaktoz genini de (gal+) birlikte
alır. Eğer, bu faj, gal- bir mikroorganizmayı infekte ederse, bunu gal+
haline sokar. Bu tarz transdüksiyon 10-6-10-7 oranında
gerçekleşmektedir. Triptofan genin yanına yerleşen Ø 80 fajı da; aynı lâmbda fajı gibi
hareket eder. Bazı
durumlarda, profaj, konakçı hücresinden ayrılırken ve konakçı DNA'sından bir
segment alırken buna karşılık kendi DNA'sından da bir kısmını, konakçı DNA'sı
üzerinde bırakabilir. Böylece DNA'sında eksik genler bulunan faj, bu durumuyla başka
bir bakteriyi infekte ettiğinde, bu alıcı hücre içinde eksik genlerin oluşturacağı
veya sentezlediği önemli ürünleri bulamazsa ve bu bakteri de, eğer bu ürünleri
sentezleyecek bilgilere haiz başka bir fajla infekte olmazsa, eksik olan faj genomu
replike olamaz ve olgunlaşamaz. Böyle transdüksiyona da sınırlı transdüksiyon adı verilir. 04.03. Abortif Transdüksiyon Fajlar
tarafından, konakçısından alınan ve bazı karakterleri (genleri) taşıyan DNA
segmenti, faj başka hücreyi infekte ettiğinde, bu hücreye aktarılır. Ancak, bu DNA
parçası hücre içinde kalır, bakteri DNA'sı ile birleşmez. Bağımsız olarak hücre
içinde bulunmasına karşın, hücre DNA'sı ile eş zamanda replike olma kabiliyetine de
sahip değildir. Ancak, taşıdığı karakterler yönünden hücreyi pozitif hale
getirebilir. Bakterinin her bölünmesinde, bu ekzogenot bir kardeş hücrede kalır ve
onu pozitif hale sokar. Böylece DNA segmenti replike olmadan, bakterinin her
bölünmesinde bir hücre kalmış olur. İlk
başlangıçta, bu ekzogenotu taşıyan ve fakat sonra, hücre bölünmesi sonu, diğer
hücrede kalması nedeniyle sonradan bunu kaybeden bir bakterideki enzimler, müteakip
bölünmeler de giderek azalır ve kaybolur. O zaman hücreler, bu enzimleri ihtiva
etmediğinden negatif hale dönüşürler.
05. Genetik Rekombinasyonlar Verici
bir bakteriden, çeşitli tarzlarda aktarılan genetik materyallerin (ekzogenot) beklenilen etkinlikte olabilmesi
için, sitoplazma içinde bulunmasından ziyade,
alıcının kromozomu ile birleşmesi (integre olması) gereklidir. Bu olguya rekombinasyon adı verilmektedir. Bazı
durumlarda alıcının sitoplazmasına giren yabancı DNA sekansları, burada kalabilir ve
kromozomla birleşmeyebilir. Böyle durumlar, daha ziyade alıcı ile verici hücre DNA
kompozisyonlarının farklı olduğu hallerde meydana gelebilir. Böyle olgular, sekanslar
arasında homolog bölgelerin veya özel birleşme yerlerinin çok az veya olmamasından kaynaklanır. Alıcının
DNA'sına integre olan verici DNA sekansları, kromozomun bir devamı veya bir parçası
haline gelerek, onunla birlikte ve eş zamanlı (senkronize)
olarak replike olur ve ekspere edilir. Replike olan DNA segmenti, kardeş hücrelere de
taksim edilir. Eğer
aktarılan yabancı DNA sekansında, alıcıda bulunmayan özel genler varsa, bunlar da
aynen aktarılır ve alıcı hücre bu genlerin taşıdığı özel karakterler yönünden
pozitif hale gelebilirler. Ancak, bazı durumlarda da, yabancı DNA sekansları,
alıcının baz sıralarını değiştirerek veya genleri bölerek mutasyonlara yol
açabilir. Sitoplazmaya
ulaşıp ta alıcının kromozomu ile birleşmeyen sekanslar, alıcının
endonukleaseları tarafından kolayca parçalanabilir ve etkinliği böylece giderilmiş
olur. Yabancı
DNA sekanslarının alıcının kromozomu ile integre olabilmesi başlıca 3 mekanizma ile
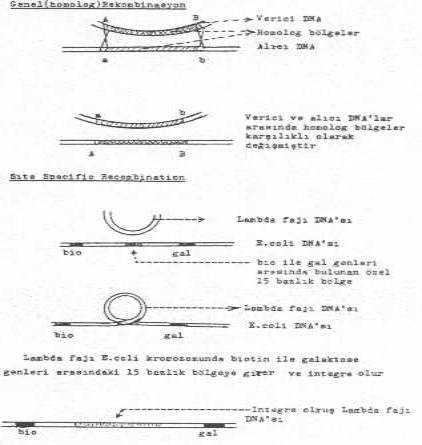
gerçekleşmektedir. 1) Homolog (genel) rekombinasyon 05.01. Homolog (Genel) Rekombinasyon Bu
tarz rekombinasyonda, alıcının hücre duvarından ve belirli yerlerinden içeri giren
lineer formdaki DNA segmentleri hemen sirküler
forma dönüştürülür. Böyle bir molekülde bulunan ve alıcının kromozomu
ile komplementer (homolog) olan bölgeler
karşı karşıya gelirler. Homolog bölgelerde meydana gelen karşılıklı kopmalar
sonunda, vericinin sekansları alıcının DNA sekansları arasında krosoverla (crossover) integre olur. Homolog
rekombinasyonda rec A+ gen ürünü proteinlerinin önemi
oldukça fazladır. Bu gende oluşan mutasyonlar veya bu geni taşımayan rec A- mutantlarında
homolog rekombinasyon meydana gelememektedir. Bu genin, aynı zamanda bakterinin
UV-ışınlarına ve X-ışınlarına duyarlı hale gelmesinde de rolü vardır. Genel
rekombinasyonda, rec A'nın yanı sıra, rec B ve
rec C gen ürünlerinin de etkinliği bulunmaktadır. Bu son iki genin
inaktivasyonu, rekombinasyon oranını %1 kadar azaltabileceği bildirilmiştir. Bunların
dışında diğer bazı genlerin de rekombinasyonda görevi olduğu belirtilmektedir.
Homolog
rekombinasyonun yukarda açıklandığı gibi çift iplikçikli iki DNA sekansı arasında
(alıcı-verici) olabileceği gibi (Holliday modeli),
tek iplikçik ekzogenotun da rekombinasyon yapabileceği belirtilmiştir. Şöyle ki,
hücre duvarından tek iplikçik DNA sekansı halinde sitoplazmaya girdikten sonra
alıcının homolog bölgesi ile birleşmeden önce çift iplikçikli sirküler hale
getirilir ve sonra birleşir veya tek iplikçik şeklinde alıcının homolog bölgesine girer ve burada çift
iplikçikli forma dönüştürülür. Genel
(homolog) rekombinasyonda, ekzogenottaki homolog bölge ile alıcının DNA'sındaki
homolog bölgeler karşılıklı yer değiştirir. Bazen de alıcının homolog bölgesi
sitoplazmaya geçer ve burada endonukleaseler tarafından ayrıştırılır. Dışarıda
(sitoplazmada) kalan ekzogenotun homolog olmayan ve integrasyona dahil olmayan bölgeleri
de aynı şekilde enzimlerle parçalanır. Mikroorganizmalar
arasında başlıca genel rekombinasyon türleri aşağıda çok kısa olarak
bildirilmiştir. 1)
Bakteri X bakteri rekombinasyonu:
Bakteriler arasında konjugasyon, transformasyon ve transdüksiyon suretiyle aktarılan ve
bazı spesifik karakterler taşıyan DNA segmentleri (genler) alıcı hücreye girdikten
sonra, hücre DNA'sı ile integre olduğuna gösteren bir çok çalışmalar
bulunmaktadır. 2)
Faj X faj rekombinasyonu: Bu
tarz fajlar arası genel rekombinasyon E. coli 'nin lambda,
T2, T4 ve i Æ174 fajlarında
rastlanmıştır. a)
Lambda X Lambda rekombinasyonu: E. coli 'yi
aynı anda infekte eden iki farklı özellik taşıyan lambda faj DNA'larının homolog
bölgeleri arasında kopmalar ve karşılıklı birleşmeler (cross over) sonu rekombinant
faj DNA'sı meydana gelir. b)
T2 X T2 rekombinasyonu: E.
coli 'ye ait bazı karakterler
yönünden birbirinden farklı olan T2 fajları (h- r+ ve h+
r-) aynı anda E. coli 'yi
infekte ettiklerinde, katı ortamda rekombinasyon gösteren 4 tür farklı plaklar meydana
gelmektedir.(h-r+, h+r+,
h-r-, h+r+) c)
T4 X T4 rekombinasyonu: E.
coli 'ye ait T4 fajları, arasında
da genel rekombinasyonun varlığı gösterilmiştir. Biri 32p ve diğeri de 15N 13C ile işaretli iki T4 fajı ile infekte edilmiş E.
coli 'de her iki karaktere sahip
fajlar elde edilebilmiştir. d)
Ø X 174 X Ø X 174 rekombinasyonları: Tek
iplikçikli sirküler olan bu faj türünde de benzer rekombinasyona rastlanmıştır. Bu
fajların hücre içindeki sirküler formları arasında genel rekombinasyonun varlığı
saptanmıştır. 3)
Plasmid X plasmid rekombinasyonu: E. coli
'ye ait olan Col E1 plasmidleri, hücre içinde genel
rekombinasyona maruz kaldıkları gösterilmiştir. Önce, plasmidler homolog noktada 8
rakamı şeklinde birleşirler. Sonra, birbirine temas eden karşılıklı iki halkada
kopma meydana gelerek rekombinasyon gerçekleşir. Yukarıda
bahsedilen ve hücre içinde meydana gelen plasmid-plasmid rekombinasyonu, hücre
dışında yani in vitro olarak da gerçekleştirilebilir. Rekombinant DNA teknolojisi
yardımıyla iki plasmid birleştirilerek yeni rekombinant
plasmid meydana getirilebilir ve bu, bakteri içine transfer edebilir. Plasmidlerle
transpozonlar birlikte bulunabilir. 4)
Bakteri X plasmid rekombinasyonları: E.
coli
'ye ait
olan F-faktörü (fertilite faktörü),
bu bakteri DNA'sı üzerinde 10'dan fazla
homolog bölgeye integre olabildiği ve bakteriyi Hfr (high frequency recombination) haline
getirdiği saptanmıştır. 5)
Virus X virus rekombinasyonu:
Lineer DNA'ya sahip viruslarda (adenovirus, herpesvirus, poxvirus), bunların temperatür
sensitif (ts) mutantları veya ts plak tipi mutantları arasında genetik
rekombinasyonlara rastlanılmıştır. Rekombinasyon, aynı zamanda, aynı grup içinde
olup ta farklı tipteki viruslar arasında da (Adenovirus-tip-2 ile tip-5)
görülmüştür. RNA
karakterinde genetik materyale sahip viruslarda (Influenzae virusu) rekombinasyon
gözlemlenmiştir. Özellikle, segmentli genoma sahip olanlarda %50'ye varan bir
sıklıkta bu fenomen görülmektedir. Segmentler arasında oluşan rekombinasyonlar, segment reassortmenlerine yol açmakta ve bunun
sonucunda da antijenik varyasyonlar meydana gelmektedir. 05.02. Site Specific (Özel ) Recombination Bu
tür rekombinasyon, recA
gen ürünü proteinine bağımlı değildir. Bu nedenle de recA-
mutantlarında da rekombinasyon meydana gelmektedir. Bakterilerin kromozomları
üzerinde, bazı yabancı genler için özel alıcı bölgeler
bulunmakta ve buradan integrasyon gerçekleşmektedir. Bu tür rekombinasyona en iyi
örnek E. coli K-12'ye ait Lambda (l) fajı
verilebilir. Bu faj lizojenik formda, bakteri kromozomunda biotin ile galaktoz genleri
arasında bulunan 15 bp'lik özel bölgeye integre olur. Faj DNA'sının bu bölgeye
girmesi için fajda bulunan int gen ürünü proteinine (integrase) ihtiyaç vardır. İntegrase
DNA'da bu özel bölgede çentik açabilir ve kapatabilir. E.
coli
K-12
kromozomu üzerinde biotin ile galaktoz genleri arasındaki bu spesifik bölge att (attachment lambda)
ile lambda fajındaki attB
bölgelerinde oluşan kopmalar, faj DNA'sının kolayca girişini sağlar. Bu girişi
integrase enzimi katalize eder. Çapraz bağlanma ile giren faj DNA'sı, kromozomun bir
parçası ve devamı haline gelir (profaj). Birleşen
yerler DNA ligase ile kapatılır. Bu
integrasyon aynı zamanda lizojeniyi de
oluşturur. 05.03. Nonhomolog Rekombinasyon DNA
segmentleri arasında genetik homolojiye dayanmadan birleşmeler nonhomolog rekombinasyonlar
olarak tanımlanmaktadır. Bu tür rekombinasyonlar, recA gen ürünü proteinlerine de
bağımlı değildirler. Bakterilerde
rastlanan Transpozonlar
(Tn) ve İnsersiyon
sekansları (İS-elementleri), bakteri veya plasmid üzerinde veya karşılıklı
yer değiştirmeleri bu tür rekombinasyon için örnek kabul edilmektedir.(Mutator faj). Bakteriyofaj
Mu faj (mutator faj, 38 kb) da aynı
tarzda yer değiştirebilen genetik materyaller arasında bulunmaktadır. Bu
tür rekombinasyonun meydana geliş mekanizması hakkında özlü bilgiler "Transpozonlar ve
İS-elementleri" bahsinde verilmiştir. 06. Prionlar ve Replikasyonları İnsanlarda
(Kuru, CJD, GSS, FFI) ve hayvanlarda (Scrapie, BSE, TME, FSE, vd) Transmissible Spongiform Ensefalopati (TSE)'lere Prion
proteini (PrP) olarak tanımlanan ajanların neden olduğu açıklanmıştır. Bu
etkenlerin 20 nm'den küçük oldukları ve 254 amino asitlik sekanslara sahip oldukları
belirtilmiştir. Ajan,
DNA veya RNA gibi, bakteri veya viruslarda bulunan genetik materyallerin hiç birine sahip
olmaması, yüksek ısıya dayanması, DNase ve RNase'lardan etkilenmemesi nedeniyle virus
veya bakteri olarak kabul edilmemektedir. Etkenin proteinaz K, iyonizan ışınlara,
UV-ışınlarına, yüksek ısıya (134-138°C ve 60 dk), nukleazlara (DNase, RNase) ve
bazı dezenfektanlara (formol, Beta-propiolakton) dirençli, buna karşın proteolitik
enzimlere duyarlı olduğu açıklanmıştır. Elektron
mikroskopla yapılan çalışmalarda, BSE'li hayvanların beyninde, aynen Scrapie'li koyunlarınkinde rastlanan SAF'ların (Scrapie associated fibrin) eş değeri olan amiloid fibril (amiloid plaklar, amiloid proteinler,
amiloid flament) kümeleri oluşur (10-20 x 100-250 nm boyutlarında). Bu
fibrillerin hastalık oluşturma yetenekleri vardır ve bunlar prion proteinlerinin (PrPSC)
de esasını oluştururlar. Bu amiloid flamentlerden elde edilen 33-37 kDa'luk major proteinlerin aminoasitlerini kodlayan DNA
baz sıraları (prion protein geni)
saptanmıştır. DNA analizlerinden hareket ederek hazırlanan işaretli (32P) oligonukleotid problar yardımı
ile (Prob hibridizasyon) genin yeri
belirlenmiştir (insanlarda 20. ve farelerde 2. kromozomda), Bu prion proteini geni,
koyunlarda Sip geninin (Scrapie incubation
period) eş değeridir. Bu gen (Prn geni), hayvanlardaki transmissible
ensefalopatilerde inkubasyon süresini kontrol eden proteinleri kodlamaktadır. Amiloid
fibrillerden hazırlanan proteinlere karşı oluşturulan antiserumların SAF'ları
presipite ettiği ve bunların infeksiyöz yeteneklerini nötralize ettikleri
açıklanmış ve bu antikorların da spongiform ensefalitik hayvanların beyninde
lokalize olabilecekleri belirtilmiştir. Koyun
ve keçilerin doğal Scrapie hastalıkları arasında farkın olması, buna karşın
BSE'nin doğal ve deneysel infeksiyonlarında bir uniformitenin bulunması, Scrapie ile
BSA hastalığı arasında bir suş karakteristiğinin olabileceğini ve hatta, bunlar
ile, insanlardaki spongiform ensefalopatilerin etkenleri arasında da bir farkın
bulunabileceği üzerinde durulmaktadır. BSE'li hayvanlardan (sığırlardan),
sığırlara yapılan deneysel transferler sonunda oluşan hastalığın tablosu, ile,
Scrapie'li koyunların infekte materyallerinden yapılan infeksiyon denemelerinde meydana
gelen hastalığın klinik belirtileri arasında azda olsa bir değişikliğin bulunduğu
açıklanmıştır. Bu durum, BSE ile Scrapie ajanların arasında da bir suş farkının
olabileceği görüşünü ortaya koymaktadır. Hastalığın
nedeni üzerinde araştırıcılar bazı görüşler ileri sürmüşlerdir. Bunlar
arasında virus, virion, prion proteini kombine
ajan ve genetik bozukluklar en önemlilerini oluşturmaktadır. Ancak, bunlardan prion protein
görüşü, deneysel olarak da destek gördüğünden, en fazla taraftar toplayan
ajan niteliğini taşımaktadır. Fare
embriyolarına mutant Sip geni sekansları
verilerek oluşturulan transjenik farelerde
spongiform ensefalopatilerin meydana gelmesi bu genin hastalıktaki rolü ve etkinliğini
kanıtladığı gibi, konjenital Prn-p geni
bulunmayan farelerde hastalığın oluşturulamaması da,yine, bu genin önemini ortaya
koymaktadır. Prion
proteinlerinin vücutta replikasyonlarını izah etmede bazı görüşler ileri
sürülmüştür. Bunlardan iki tanesi aşağıda özet olarak verilmektedir. 1)
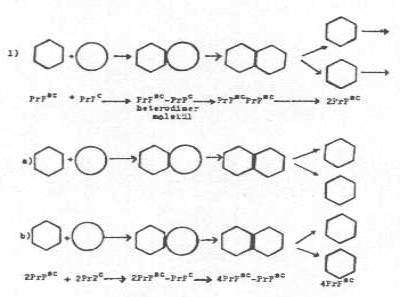
İnfeksiyon teorisi:
Vücuda giren patojenik prion proteini (PrPSC), normal prion protein geni (PrP geni,
Prn-p) ürünü olan PrPC ile birleşerek bir
heterodimer molekül (PrPSC-PrPc) meydana getirir. Bu birleşme sonunda, normal
sellüler protein de (PrPc), konformasyonal
değişiklikler oluşarak patojenik veya abnormal isoform PrPSC
haline dönüşür. Böylece, 2 tane PrPSC veya
abnormal isoform PrPSC meydana gelir. Bu iki
molekül birbirinden ayrılarak her biri tekrar birer PrPc ile bağlanarak bunları patojenik PrPSC'ye çevirir. Böylece, 4 tane PrPc ortaya çıkar. Bunlarda benzer tarzda
replikasyona devam ederler. Bu tarz replikasyon sonunda vücutta PrPSC'ler birikirler. Bunların, afinitesi nedeniyle
beyinde toplanması toksik etki meydana
getirerek semptomların görülmesine neden olurlar.
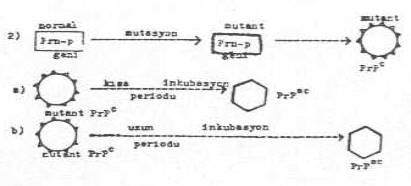
2) Genetik teori: Normal hücrelerde prion
proteinlerini (PrPc) kodlayan gen, PrP geni (Prn-p geni) bulunmaktadır. Bu gen,
insanlarda 20. kromozom ve farelerde de 2. kromozomun kısa kolu üzerinde lokalize
olmuştur. Bu gende meydana gelen mutasyonlar
(polimorfizm), mutant Prn-p geninin ve dolayısıyla da mutant PrPc'nin
oluşmasına yol açarlar. Orijinalinden değişik baz sıralarına sahip olan bu gen,
fraklı karakterde amino asitlerin kodlarına sahip olduklarından, protein zincirine
değişik amino asitlerin girmesine neden olur. Bu mutant polipeptid, vücutta uzun veya
kısa bir zaman süreci içinde, spontan
konformasyonal değişikliklere maruz kalarak, patojenik isoform PrPSC'lerin oluşmasına yol açarlar. Bu
değişikliğin meydana gelme zamanına göre inkubasyon süresi uzun veya kısa
olur.
[1] Kaynak: Temel Mikrobiyoloji |
||||||||||||||||||||