|
Genler ve Fonksiyonları Prof. Dr. Mustafa Arda
Ankara Üniversitesi
Veteriner Fakültesi
Genler,
hücrelerin ve dolayısıyla da canlıların kalıtsal karakterlerinin, yaşamları için
gerekli olan proteinlerin, enzimlerin, diğer makro- ve mikromoleküllerin kodlarını
taşıyan, kromozom üzerinde lokalize olmuş, değişik uzunlukta (kodladığı proteinin
büyüklüğüne göre) DNA sekanslarıdır. Genler, aynı zamanda, canlılardaki bütün,
genetik, biyokimyasal, fizyolojik, vs. olayların denetimini, doğru yönde ilerlemesini
de kontrol ederler. Bir kromozom üzerinde, prokaryotiklerde 2000-3000 ve ökaryotiklerde
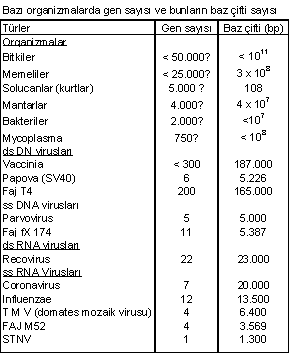
de 50.000-100 bin arası gen bulunmaktadır. Aşağıdaki
tabloda bazı organizmalarda gen ve baz sayıları gösterilmiştir.
Genlerin
kromozom üzerindeki sırası ve sayısı organizmalara göre belli bir düzen ve sıra
içindedir. Bu uyum türler için sabittir ve değişmez. Ancak, cinsler veya familyalar
arasında farklar gösterebilir. Bu düzenli sıralanış, bir tespih tanesine veya bir
müzik kasetinde magnetik tape de bulunan ve ardışık yerleşmiş müzik parçalarına
benzetilebilir. Genlerin
büyüklüğü de (baz sayısı) kodladığı proteinin büyüklüğüne göre
değişebilir. Bu ölçü, 1500-2000'den 10000 bp'e kadar değişebilir. Genler,
nukleik asit sekanslarından oluşmakta ve belli özel peptidlerin bilgilerini kodlar
halde taşımaktadırlar. Genleri oluşturan baz sıraları ve sayıları da türler için de sabittir ve bu
türlerin korunmasında çok önemli rollere sahiptir. Ancak, her amino asit'in spesifik
bir veya birden fazla kodonla (triplet) belirlenmesi, bunların da 3'er tane nukleotid
bazından oluşması, çok sayıda replikasyonların meydana gelmesi, polimerizasyon
sırasında enzimlerin duyarlılıklarının azalması nedeniyle yanlış bazların
sıraya girmesi veya mutasyonları indükleyici faktörlerin ortamda bulunması, vs.
nedenler nadir de olsa (10-7-10-9 oranında) baz sıraları arasında bazı
değişikliklerin oluşmasına yol açmakta ve mutasyonların gelişmesine neden olmaktadır. Böyle
varyasyonların sonunda da parent hücrelerden farklı genotip ve fenotipte yeni nesiller
(mutant) meydana gelmektedir. Bazı
mutasyonların hafif veya belli-belirsiz olmasına karşın bir kısmı da öldürücü
nitelik taşıyabilir. Prokaryotiklerde
nukleik asitteki baz sıraları ile kodlanan proteindeki amino asit sıraları arasında
bir düzen ve uyum vardır ve kesintisizdirler (kolineer).
Bakterilerde ve bakteriyel viruslarda, genler kesintisiz olarak birbiri arkasına
sıralanmalarına karşın, ökaryotiklerde ve bazı viruslarda, genler içi ve genler
arasında hiç kodlama yapmayan (noncoding) sekanslar bulunmaktadır. Bunlara
genel olarak intron (intervening sequence) adı verilmektedir. Buna
karşın kodlayan sekanslar da, ekson
olarak tanımlanmaktadırlar. Böyle kodlamayan sekanslar hem genleri bölmekte ve hem de
iki gen arasını açmaktadırlar. Örn., alfa
kollagen geninin 50'ye yakın bölüme ayrıldığı belirtilmektedir.
İntronların uzunlukları da değişik olmasına karşın 2-3 kb uzunluğa kadar
olabildiği açıklanmıştır. Hatta, bazıları eksonlardan da daha uzun olduğu
bildirilmiştir. Ökaryotiklerde, DNA üzerindeki böyle durumlar genlerin uzunluğu ile
kodlanan proteinin uzunluğu arasında bir farkın meydana gelmesine de neden olmaktadır.
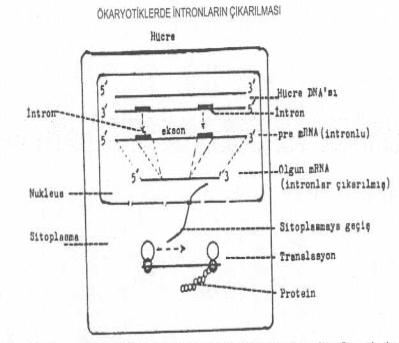
Ancak, transkripsiyon sırasında pre mRNA da
eksonlarla birlikte intronlar da bulunmasına karşın, bunun prosesi sonu sentezlenen olgun mRNA'da sadece eksonlar bulunur ve
intronlar çıkarılır. Çekirdek içinde meydana gelen bu olgudan sonra, olgun mRNA
çekirdek etrafındaki deliklerden geçerek sitoplazmaya girer ve burada ribosomlara
yerleşerek translasyona tabi tutulur.
Her ne
kadar intronlar ökaryotiklerin DNA'larında görülüyorsa da, ökaryotiklerden olan
mayaların genomundaki genlerin çoğu intronsuzdur. İntronların
çıkarılarak eksonların yan yana getirilip birleştirilmesi fenomeni hakkında çok
fazla bilgi bulunmamakla beraber, araştırıcılar bazı görüşler ileri
sürmektedirler. Şöyle ki, birleştirilmede snurpların
(snRNA: small ribonucleoprotein particle) rolü
üzerinde durulmaktadır. Bu substanslar nukleusda bulunur ve yapısında RNA ve
proteinler vardır. Urasilden zengin olan snurpların ekson-intron kavşak yerleri için
komplementer sekanslara sahip olduğu ve bu bölgeye kolayca tanıyarak bağlandığı,
intronları hidrolize ederek çıkardığı ve eksonları birleştirdiği
açıklanmaktadır. Ökaryotiklerde
intronlar her ne kadar kodlamayan sekanslar olmasına, yani herhangi bir spesifik
proteinin kodlarını taşımıyor ve kodlamıyorsa da, regülatör bir fonksiyona sahip
oldukları araştırıcılar tarafından belirtilmektedir. Ancak, bazı istisnalar da
bulunmaktadır. Örn, mayalardaki mitokondrial DNA'daki intronların protein kodladığı
ve bunun eksonların kodladığından bağımsız fonksiyona sahip olduğu
bildirilmektedir. Çok nadir de olsa, bazı durumlarda, tek bir genin iki proteini
kodlayabildiği açıklanmıştır. Bunun başlıca nedenlerinden birisinin
transkripsiyonun farklı noktalardan başlaması olduğu belirtilmektedir. Ayrıca, iki
genin aynı sekansı paylaşması durumları ortaya çıkmakta ve bunun da DNA'nın
farklı şekilde okunmasından kaynaklandığı ileri sürülmektedir. Ökaryotiklerde
transkripsiyon sonucu sentezlenen tek iplikçik mRNA'lar posttranskripsiyonal proseslere ve translasyon
sonucu meydana gelen proteinler de posttranslasyonal
proseslere (işlemlere) tabi tutulurlar. mRNA'ların prosesinde, 5-' ucuna 7-
metilguanosin ve 3'-ucuna da poliadenilatların (poli AA.....) ilavesi; intronların
çıkarılması, eksonların yan yana getirilerek olgun mRNA'nın oluşturulması ve bunun
translasyon için sitoplazmaya transferi; proteinlerin prosesinde ise sentezlenen
proteinlerin katlanması, amino asitlerin kimyasal modifikasyonları, fosforilasyon,
glikolizasyon, acylation, proteolitik ayrışmalar gibi işlemlere tabi tutulurlar.
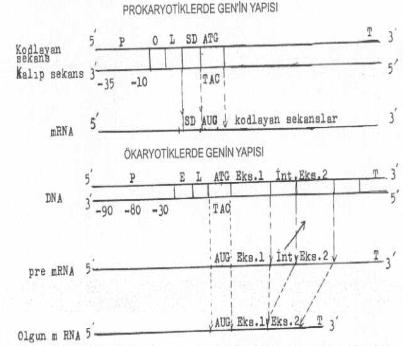
01.01. Promoter (P) DNAya
bağımlı RNA polimerase enziminin bağlandığı bölgedir. Buna ait yeterli bilgi sayfa
149'de verilmiştir. Ökaryotiklerde bu bölgede 3 önemli lokalizasyon bulunmaktadır.
-90, -80 ve -30 bölgeleri en fazla korunan yerler arasındadır. Prokaryotiklerle aynı
fonksiyona sahiptir (-35 ve -10 bölgeleri). 01.02. Operatör sekans (O) Bu
bölgede represör ve aktivatörler etkinlik gösterir. Promoterin hemen sağında
bulunur. 01.03.
Lider sekans (L) mRNA'da
transkripsiyonun başlama noktasından sola doğru (5' -terminusa doğru, upstream) yerleşmiş sekanslardır. Bu
kısım ribosomlarda translasyona tabi tutulmaz. Uzunluğu prokaryotik ve ökaryotiklere
göre, yaklaşık 20-100 baz kadar olan lider sekans, mesajın ribosomlara iyice
bağlanmasında etkin role sahiptir. Prokaryotik ve ökaryotiklerde aynı fonksiyondadır. 01.04. Shine Dalgarno sekansı (SD) AUG
kodonundan sola (5'-ucuna) doğru -7 bölgesinde bulunan polipürin karakterinde (AGGA GG)
sekanslardır. Bu bölge, 16S rRNA'nın 5' -terminusu ile komplementerdir. Ribosomun
mRNA'ya bağlanmasını sağlar. Prokaryotiklerde vardır ve mRNA'ya aktarılır. 01.05. Enhenser Ökaryotiklerde
bulunan bu sekansın transkripsiyonu stimule etme aktivitesi bulunmaktadır. 01.06. AUG Kodonu mRNA
üzerinde, transkripsiyon için başlama sinyali veren ve formilize olmuş methioninin
kodonudur. Buradan sağa doğru (3' -terminusa, down
stream) polimerizasyon devam eder. AUG'nin transkripte edilen DNA sekansı (3' ¬ 5')
üzerindeki tripleti TAC'dir. mRNA'ya
aktarılır. 01.07. Kodlayan Sekanslar (Ekson) TAC kodonundan itibaren sağa doğru polimeraz
enziminin mRNA'yı sentezlediği ve genetik bilgilerin anlamlı DNA'dan mRNA'ya
aktarıldığı bölgedir. 01.08. Kodlamayan Sekanslar (İntron) Bu
sekanslar genler içinde ve genler arasında bulunabilir ve genlerin aralarını açarlar.
Bunlar ökaryotiklerde ve bazı viruslar da vardır. 01.09. Terminatör (T) DNA
üzerinde, RNA polimeraz enziminin transkripsiyonu durdurma sinyalini veren sekanstır.
DNA'da bulunan terminasyon kodonları, ATC, ATT ve ACT olup, bunların mRNA daki tripleri
ise UAG (amber), UAA (ochre) ve UGA, (opal) dır ve protein sentezini durdururlar.
Bunlara aynı zamanda nonsense kodonlar da
denir. mRNA'ya aktarılır. Genlerin izolasyonları, çıkarılması, transferleri, klonlanması, ekspresyonları ve diğer aktiviteleri hakkında ilgili bahislerde yeterli bilgiler verilmektedir.
02. Psödogenler (Yalancı
Genler)
Psödogenler
(yalancı genler), fonksiyonel genlerle ilişkisi olan, fakat bir aktif protein haline
transle edilemeyen genler olarak tanımlanmaktadırlar. Bazı araştırıcılar da, böyle
genleri, fonksiyonel olan genlerin etkinliği olmayan kopyası olarak kabul etmektedirler.
Psödogenler genellikle y sembolü ile ifade edilirler. Psödogenler,
fonksiyonel genlerin genel yapısına benzer sekanslara (intron ve ekson) sahiptirler.
Replikasyonun çeşitli aşamalarında meydana gelen spontan veya indükleyici etkenlerin
etkisi ile oluşan mutasyonlar sonu inaktif hale gelmişlerdir. Örn., transkripsiyonun
başlamasını veren sinyal bazlarında bozukluklar mRNA sentezini ve dolayısıyla da
translasyonu olumsuz yönde etkiler ve bu önemli fonksiyonlar ortadan kalkarlar. Psödogenlere
bir çok protein genlerinde rastlanılmıştır. Örn., globin, immunglobulin ve
histokompatibilite antijenleri genleri, vs.de böyle inaktif genlere sahiptirler. Bunun
tipik örneği tavşanların psödogeni (ß2) olup, bu gen ekson ve intronlardan
oluşmakta ve bu da yapısal olarak fonksiyonel aktif globin genine (ß1) çok benzemektedir. RNA
transkriptine (mRNA) benzeyen inaktif genomik sekanslara işlenmiş psödogen (processed pseudogene) adı verilmektedir. İnaktif
genler, yine çeşitli mutasyonlarla aktivite kazanabilirler.
03. Gen
Ekspresyonunun Artırılması Hücrelerde
gen sayısının ve gen ekspresyonunun arttırılması için değişik metotlar
kullanılmaktadır. Bunlardan önemli olanlarından bazıları aşağıda bildirilmiştir. 03.01. Gen Sayısının Artırılması a)
İstenilen bir ürünün veya proteinin sentezini kodlayan gen (hedef gen) kromozomdan
uygun bir restriksiyon enzimi kullanılmak suretiyle kesilerek çıkarılır ve pürifiye
edilir. Bu gen, hücre içinde çok fazla üreyebilen veya kopyası fazla olabilen bir
plasmidin DNA'sı ile birleştirilir. Bu amaçla daha ziyade küçük suni plasmidler
tercih edilirler. Çünkü, küçük plasmidlerin hücre içindeki kopya sayıları
genellikle fazla olabilir. Bu rekombine plasmid alıcı bir hücreye transfer edilerek,
genleri taşıyan plasmidlerin fazlaca üremesi sağlanır. Sonra bunlardan gen
çıkarılır. b)
Plasmid
ile birleştirilen hedef gen, uygun bir alıcı bakteriye transfer edildikten sonra, bu
konak bakteri, içinde 150 mg/ml
Chloramphenicol bulunan besi yerine transfer edilir. Böyle bir ortamda mikroorganizma
içinde plasmidin çok sayıda kopyası (bakteri başına 1000'den fazla) oluşur ve
böylece gen sayısı da artmış olur. Ancak bu mikroorganizmada ekspresyon meydana
gelmez. Çünkü antibiyotik protein sentezini inhibe eder buna karşın plasmidin sayıca
artmasına mani olmaz. c) Hedef
genin baz sıraları iyice biliniyorsa, bu takdirde, laboratuvarda sentetizerler yardımı ile sentetik gen
hazırlanabilir ve başarı ile kullanılabilirler. d)
Hedef
gen taşıyan DNA (veya mRNA), in situ PCR yöntemi ile çoğaltılır ve bundan gen
çıkarılarak kullanılır. 03.02. Gen Ekspresyonunun Artırılması Genin
amplifikasyonu, her zaman, aynı genin ekspresyonu ile paralel gitmeyebilir. Gen
ekspresyonunun istenilen düzeye çıkarılması için bazı yöntemler
kullanılmaktadır. Bunlar da özetle şöyledir. a)
Hücrelerde DNA'nın transkripsiyonunda önemli fonksiyonu olan RNA polimeraz enzimi
promoter bölgesine bağlanarak, buradan itibaren 3' -ucuna doğru (downstream)
transkripsiyonu gerçekleştirilir. Ancak, bu tarzdaki ekspresyon her zaman aynı kuvvette
olmaz. Diğer bir ifade ile, eğer bir gen, bir hücrede yüksek düzeyde eksprese
edilebiliyorsa (fazla ürün sentezi oluşuyorsa) kuvvetli
promotere sahip olduğu
düşünülür. Bu nedenle promoterin kuvvetli olması veya özel bir tarzda modifiye
edilerek kuvvetlendirilmesi gereklidir. b)
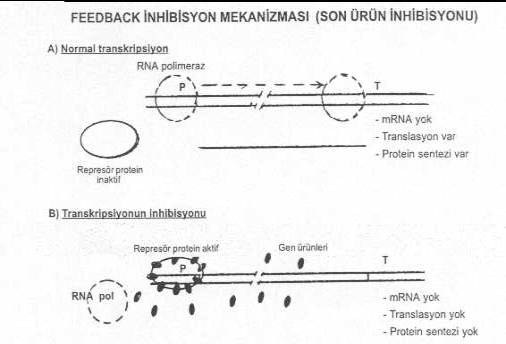
Hücrelerde genin ekspresyonu da kontrol altına alınabilir ve regule edilebilir. Örn., E. coli 'de, aminoasitleri kodlayan
genler, eğer bu aminoasitler hücrede çok fazla miktarda bulunuyorsa represe edilerek,
yeniden aminoasit sentezi durdurulur (feedback
inhibisyon). Bu fenomenin mekanizması kısaca şöyledir: Hücre içinde bulunan
ve inaktif bir karakterde olan represör
proteinlere gen ürününün bağlanması represör moleküllerini aktive ederek,
promoter bölgesine bağlanmasına yol açar. Bu durumda RNA polimeraz enzimi promotere
bağlanamadığından genin ekspresyonu da gerçekleşemez. Feedback
inhibisyonun ters mekanizmasını oluşturarak genin ekspresyonunu artırılabilir.
Şöyle ki, eğer represör proteinlerin aktive olması önlenirse ve böylece de
promotere bağlanması inhibe edilir ve bakteriler fazlaca gen ürünü eksprese
edebilirler. Bunu sağlamak için de, promoter bölgesinde bulunan operatör sekanslarda
bazı modifikasyonlar yaparak veya represör proteinleri kodlayan genlerde mutasyonlar
meydana getirerek bu proteinlerin promotere bağlanması önlenebilir ve böylece genin
ekspresyonu devam eder, kapanmaz. Araştırıcılar,
son yıllarda, genlerin fonksiyonları için gerekli olan promoter ve terminatör
sekansları değiştirebilmekte ve yeni ortama adapte olabilecek ve iyi bir etkinlik
gösterebilecek tarzda modifiye edilebilmekte ve düzenleyebilmektedirler. Yeni ortamda
fonksiyonel olamayan bir gene ait promoter ve terminatör sekansları çıkararak,
bunları transfer edilecek gende kullanmak suretiyle, bu yeni gene işlerlik kazandırmak
olanak dahilindedir. Örn., tavuk yumurta albumin geni, yaprak protein genine ait kontrol
sekanslara (promoter-terminatör) bağlandıktan sonra bir bitki hücresine (Örn., yonca)
transfer edilirse, oluşturulan transgenik bitki (yonca) yapraklarında yumurta akı
biriktirebilir. Bu durum meraların besleyici kapasitesini artırmada etkili olabilir.
Böylece, bir bitki (transgenik bitki), solar enerjiden yararlanarak fotosentetik
mekanizma ile tavuk yumurta akı proteinini üretebilir hale gelebilir. Genlerde
kontrol mekanizmasını sağlayan sekanslar (promoter ve terminatör) arasında da önemli
farklar bulunmaktadır. Bazıları ne kadar protein sentezleneceğini, bir kısmı da
genlerde hangi sinyallerin ve ne kadar respons göstereceğini ve kimileri de
organizmanın neresinde fonksiyonel olacağını tayin ederler. Promoterler, sentezlenen
proteinin miktarına göre zayıf, normal, kuvvetli (veya super promoter) olmak üzere gruplara
ayrılmaktadırlar. Biyoteknolojik yöntemlerle, bilim adamları, zayıf veya normal
promoterleri kuvvetli ile değiştirebilmekte ve genin etkinliğini artırabilmektedir.
Bir türde etkin olan promoter, eğer geni ile birlikte başka bir organizmaya transfer
edilirse bu yeni ortamda zayıf bir fonksiyon gösterebilir. Çünkü, yeni organizmanın
replikasyon ve ekspresyon mekanizmaları bu yeni promoteri tam algılayamaz veya kabul
edemez. Bu nedenle, promoterleri, yeni ortamın iyi tanıyabileceği başka bir promoterle
değiştirilmesi gereklidir. Memeli
genlerinin, bakterilerde ekspresyonunda en fazla güçlük çekilen nokta, genlerin
içinde ve genlerin aralarında bulunan ve bunları bölen ve herhangi bir kodlama
yapmayan intronlardır. Bakterilerin
ekspresyon mekanizmalarında intronları tanıyarak bunları çıkaracak mekanizmalar
bulunmamaktadır. Onun için, intronlar önceden çıkarılarak sadece eksonlardan oluşan
olgun mRNA hazırlamak ve bundan yararlanmak gerekecektir. Bakteriler aynı zamanda, bir
amino asit için olan birden fazla tripletleri değerlendirmede ökaryotikler kadar
organize olmadıkları gibi glikolizasyon reaksiyonlarına da sahip değildirler. Bu
nedenle, memeli genleri taşıyan DNA sekanslarını ve kodonları, bakterilerin kolayca
tanıyabileceği ve algılayabileceği bir tarzda değiştirmekte yarar vardır. Bakteriler
tarafından kabul edilen ve eksprese edilen genler, burada uzun süre kalabilmeli, en
yüksek düzeyde eksprese edilebilmeli, gen aktivitesi kontrol edilebilmeli, sentezlenen
gen ürünleri bakteri içinde ayrışmamalı ve kontamine olmamalıdır.
04.
Genlerin İnaktivasyonu Genetik
manipulasyonlar arasında, sadece yeni genler transfer ederek değişik ve istenen
karakterlere sahip organizmalar veya hücreler elde etmek değil, aynı zamanda,
istenmeyen genlerin aktivitesini azaltmak veya inaktive ederek fonksiyonuna tamamıyla
mani olmak gibi çalışmalar da bulunmaktadır. Genlerin kısmi veya tam inaktivasyonu
üzerinde bir çok değerli çalışmalar yapılmıştır. Bunlara ait ve önemli olan
bazı teknikler aşağıda bildirilmiştir. 1)
Mutasyonlarla inaktivasyon
04.01. Mutasyonlarla İnaktivasyon Kromozomlar
üzerinde ardışık olarak sıralanmış olan fonksiyonel genler (ancak, ökaryotiklerde
genlerin bazıları intronlarla bölünmüştür), çeşitli iç ve dış nedenlerin
(fiziksel, kimyasal, biyolojik, metabolik, fizyolojik mutajenik maddeler, vs.) etkisi
altında gelişen mutasyonlara bağlı olarak, bazı değişikliklere (bazların girmesi,
çıkması, karşılıklı bağlantıların değişmesi, vs.) maruz kalmaktadırlar.
Genetik düzeyde oluşan ve özellikle, DNA'daki bazların diziliş sıralarını bozan
böyle mutasyonlar organizmaların fenotiplerini değiştiren inaktivasyonlara yol
açtığı gibi bazen de ölümlere de neden olabilmektedir. Mutasyonlar sonu parental
organizmalardan farklı özellik gösteren mutantlar
ortaya çıkmaktadır. Şöyle ki, parental organizma Lac+, Sac+
pozitif ise, mutasyonlar sonu Lac-, Sac- hale gelebilirler. Böylece, bu iki gen inaktive
edilmiş veya etkinliği ortadan kaldırılmıştır. Ancak, bazı durumlarda da gen fonksiyonunun ortadan kaldırılması arzu edilen bir durum olabilir. Şöyle ki, insan veya hayvanlarda hastalık oluşturan bir mikroorganizmadan patojeniteyi sağlayan virulens faktörlerinden bir veya birkaçı genetik manipulasyonlarla giderilebilir. Böylece, hastalık oluşturmayan mutant suşlar elde edilir ve bunlar aşı suşu olarak başarı ile kullanılabilirler.
04.02. Transpozonlarla İnaktivasyon Transpozonlar
(Tn: kromozom veya plasmidlerin üzerinde
bulunan ve yer değiştirebilen genetik elementler), yer değiştirirken önemli bir gene
girebilmekte ve genin bütünlüğünü bozarak inaktivasyonuna neden olmaktadırlar.
Ancak, kromozom üzerinde bu yer değiştirme işlemi genellikle kontrol altında
tutulamadığından veya güvenilemediğinden, istenmeyen genlerin inaktivasyonunda pek
kullanılmamaktadırlar. Bazen, kalması gereken ve çok önemli bir fonksiyona sahip
genin içine de girerek onun aktivitesine son vermektedirler. Ayrıca, inaktive olan bir
gen, sonradan transpozonun buradan ayrılması ile tekrar eski etkinliğine
kavuşmaktadır.
04.03. Bakteriyofajlarla İnaktivasyon Bazı
fajlar, bakterilerde belli bir genin yanına yerleşmekte veya içine girebilmektedirler.
Örn; E. coli 'ye ait olan Lambda
fajı, genellikle, bu bakterinin galaktoz ile laktoz genleri arasına integre olur. Faj, profaj halinde burada kalır ve
nesillere böylece aktarılır. Eğer bakteri ultraviolet ışınlarına maruz
bırakılırsa veya herhangi bir indükleyici etkenin tesirinde, bu faj aktive olur ve
buradan ayrılarak kendi konakçısını lize edebilir. Ancak, faj bakteriden ayrılırken
bazen galaktoz genini de buradan alabilir ve başka bir Gal- bakteriyi infekte ettiğinde onu pozitif (Gal+) hale
getirebilir. Galaktoz geninin ayrıldığı E.
coli 'de Gal- hale dönüşür. Mu-fajı
(mutator
faj) da, bakteri kromozomu üzerinde yer değiştirdiğinden mutasyonu inaktivasyonlara
neden olabilmektedir.
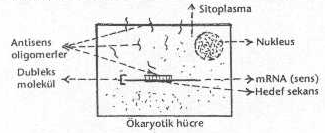
04.04. Antisens Oligonukleotidlerle Hedef Genlerin
İnaktivasyonu Son
birkaç yıl içinde, antisens oligonukleotid (oligomerler) kullanılarak, istenmeyen
(hedef) genlerin inaktivasyonlarını, malignant hücrelerin ve virusların in vivo
ve/veya hücre içinde üremelerinin inhibisyonlarını sağlamak, çok fazla üzerinde
çalışılan bir konu haline gelmiş bulunmaktadır. Henüz gelişme aşamasında olan,
in vitro hücreler üzerindeki araştırmalardan tam olarak kurtarılıp in vivo
denemelere geçilemeyen bu teknolojinin ilerde başarılı olacağına inanılmaktadır. Bu
gün hastalıkların önlenmesinde kullanılan ilaçların bir kısmı, hücre DNA'sı ile
genellikle birleşmektedirler. Ancak, ilaçlar, spesifik nukleotid sekanslarını
tanımadıkları için veya sınırlı bir tanıma yeteneğine sahip olduklarından özel
genlerin ekspresyonlarına mani olamamaktadırlar. Antisens oligomerleri ise, hücrenin normal
mRNA'sı üzerinde bulunan spesifik gen bölgelerine komplementer (veya anti paralel) olarak
hazırlandıklarından bu sekanslara kolayca bağlanabilmekte ve mRNA'nın ve özellikle
burada bulunan spesifik hedef bölgenin translasyonuna mani olmaktadırlar. Oligomerler,
yaklaşık 10-30 bazdan oluşmuş sentetik
oligonukleotidlerdir. Diğer bir ifade ile, hücre içinde mRNA üzerindeki hedef genlere (spesifik sekanslara)
bağlanarak, bunların translasyonlarını önleyen tek iplikçik kısa sentetik antisens
oligonukleotidlerdir. Bu tekniğin ilk doğal örneğine E. coli 'de
rastlanılmıştır. Prokaryotik
ve ökaryotiklerde çift iplikçikli olan DNA'dan mRNA'nın sentezinde RNA polimeraz enzimi (transkriptaz, DNA'ya bağımlı
RNA polimeraz enzimi) kullanılır. Bu enzim, DNA'nın 3'¬¾¾5'
yönünde olan iplikçiğini kalıp olarak kullanarak, bunun üzerinde olan genetik
şifreleri aynen (ancak, timin yerine urasili koyarak) yeni sentezlenen mRNA'ya aktarır.
Tek iplikçik olan bu normal hücre mRNA'sı,
kendine kalıp ödevi gören DNA iplikçiğine anti
paraleldir (5'¾¾®3') ve
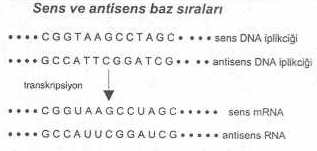
aynı zamanda, komplementerdir. Bu durum aşağıdaki şekilde gösterilmiştir. Sens
Ve Antisens Baz Sıraları
Mesenjer
RNA üzerinde bulunan hedef genlerin inaktivasyonunda genellikle iki tür strateji
uygulanmaktadır. Bunlar da, 1)
Hücrenin normal mRNA'sındaki hedef gen bölgesi içinde bulunan bazı spesifik
sekanslara anti paralel (komplementer) olan ve aynı zamanda onlarla birleşebilen çok
kısa tek iplikçik deoksiribonukleotid sekansları hazırlayarak hücrelere transfekte
etmek. Bu oligomerlerin sentezinde DNA sentetizerler kullanılabilir. Eğer istenirse, PCR
ile de sayıları istenilen düzeye çıkarılabilir. Bunların, hücrelere
transfeksiyonunda bazı tekniklerden (CaPO4
ile presipitasyon, elektroporasyon, vs) yararlanılabilir. Hücreler içine giren bu
antimesenger oligodeoksiribonukleotidler (30 bazlık), mRNA üzerindeki hedef gendeki
özel bazlarla birleşerek kısa çift iplikçik (DNA - mRNA) hibrid molekül oluşturur.
Bu dubleks sekans, ribosomlar tarafından deşifre edilemez ve kullanılamaz. Bu nedenle
de hedef gen aktivitesini kaybeder. Bu
teknikte, hücre mRNA'sının yönü 5'¾¾¾®3'
olduğundan, hazırlanan oligomerin yönü ise 3' ¬¾¾¾ 5'
olması gereklidir. Eğer,
sentetik DNA sekansı, mRNA'nın başlangıç yerinden uzaktaki sekanslara karşı
hazırlanmış ise, hızla devam eden translasyon sırasında bu dubleks çok kısa bölge
atlanarak protein sentezi devam eder. Eğer, burada tümden protein sentezi sonlanırsa,
hücrenin çok önemli olan genlerine ait ürünler sentezlenemez ve hücreler ölebilir. Eğer,
sentetik DNA sekansları mRNA'nın başlangıcındaki bazlara karşı hazırlanırsa, bu
defa tüm mRNA ribozomlara bağlanmayabilir ve böylece translasyon da tümden inhibe
edilebilir. Bu
teknikteki önemli nokta, sentetik DNA segmentlerinin hücre içindeki DNase enzimlerinin
etkisi ile ayrıştırılmasıdır. Bunun da önlenmesi gerekir. Bu yönde alınan
önlemlerin arasında modifiye edilmiş oligodeoksiribonukleotidlerin hazırlanması ve
kullanılmasıdır. Böyle oligomerler de sentetizerler tarafından kolayca sentez
edilebilmeleridir. Bu amaç için, fosforamid
ve H-fosfonate kimyasından yararlanılmaktadır. Bunlar,
hücrelere daha kolay girmekte ve ekzonukleaz ve endonukleazlardan da
etkilenmemektedirler.
Modifiye edilmiş oligomerlerin hücrelere giriş etkinliği, farmakokinetiği, doku içindeki dağılımı, toksisitesi, yan etkileri, hücre içinde veya doku içinde kendi formlarını koruyabilme durumları, etkinlik dereceleri, vs. diğer özellikle çok iyi saptanmalıdır. Bunların yanı sıra, antisens oligomerlerin selektivite (hedef genlerdeki spesifik sekansları tanıma ve bağlanma yeteneği), stabilite (hücre içinde nukleazlara direnç durumu), hücre içinde hedef sekanslara yeterli miktarda ve etkinlikte ulaşabilmeleri ve solubiliteleri (hücre membranlarından içeri kolayca girebilmeleri) ayrıntılı olarak incelenmelidir ve belirlenmelidir. 2)
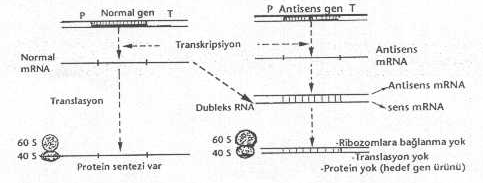
Diğer teknik de ise, sentetik olarak antisens genler hazırlamak, bunları mekik plasmid
vektörlere bağlayarak hücrelere transfer etmek, hücre içinde ekspresyonlarını
sağlamak, genin transkripsiyonunu sonucunda sentezlenen antisens tek iplikçik RNA'nın,
hücre mRNA'sındaki hedef bölge ile birleşerek istenmeyen genin translasyonuna mani
olmak, amaçlanır. Böylece oluşan dubleks RNA - RNA molekülü ribosomlar tarafında
kullanılmaz ve genin aktivitesi ortadan kalkar. Bu tekniğin aşamaları özetle
aşağıda gösterilmiştir: a)
Mesenger RNA'da bulunan hedef bölgenin spesifik sekanslarına karşı ve bununla
birleşebilecek olan antisens RNA molekülünün sentezini sağlayacak DNA sekansları
hazırlanır (tek iplikçik). Bu oligomer, hedef RNA'yı kodlayan DNA sekanslarının ters
oriyentasyonu ile elde edilir. b)
Sonra, bu tek iplikçik oligomer, çift iplikçikli hale getirilir. c) Bu
suni gene, prokaryotik ve ökaryotik hücrelerde aktivite gösterebilmesi için, bir ucuna
(5'-ucu) kuvvetli bir promotor ve diğer ucuna da (3'-ucu) terminatör sekanslar ilave
ederek bir mekik plasmid vektöre bağlanır. d)
Sonra, bu rekombinant vektör hücrelere transfer edilir. Eğer, fazla gene gereksinim
varsa, plasmid önce başka hücrelerde sayıca artırılır ve ondan sonra
kullanılırlar. e)
Hücre içinde, plasmidde bulunan DNA sekansları transkripte olur ve antisens RNA
molekülü sentezlenir. f)
Sentezlenen antisens RNA, hücrenin mRNA'sındaki hedef gene komplementer olduğundan
onunla birleşerek dubleks (RNA - mRNA) kombinasyonu elde edilir. Bu
tekniğe ait aşamalar, çok kısa olarak aşağıdaki şekilde gösterilmiştir (burada
ancak hücre içindeki olaylar belirtilmiştir). Antimesenger
oligodeoksiribonukleotidler
(antimesenger oligomerler, oligonukleotidler) hücrelere girdikten sonra, mRNA üzerinde
bulunan kendine komplementer sekanslarla birleşerek çift iplikçik (dubleks molekül)
oluşturan ve böylece mRNA'nın translasyonuna mani olan tek iplikçik, kısa sentetik
sekanslardır. İn vitro hücre kültürlerinde başarılı sonuçlar veren denemelerin,
deneme hayvanları üzerinde de (in vivo) yapılması ve çok iyi değerlendirilmesi
gereklidir. Oligonukleotidler,
özellikle, genomik RNA viruslarında mRNA'ya veya viral RNA'nın inhibisyonuna neden
olduğundan, üzerinde çok çalışmalar yapılmaktadır. Kanatlıların Rous sarcoma virusunun (RSV) '35 S RNA'sının
5'-ve 3' terminuslarındaki tekrarlanan terminal sekanslara komplementer olan 13 bazlık
oligonukleotidin, virusla infekte civciv embriyo fibroblast kültürlerinde 192-240 saat
içinde revers transkriptaz
aktivitesinde %90'lık bir azalmaya neden olduğu açıklanmıştır. En
fazla çalışma, insanlarda immunsupresyona yol açan virus (HIV) üzerinde yapılmış ve olumlu
sonuçlar da alındığı açıklanmıştır. Ancak, in vivo koşullarda henüz olumlu bir
çalışma bulunmaktadır. Hazırlanan oligomerlerin büyüklüğünün mRNA daki spesifik
sekansların inhibisyonunda etkili olduğu bildirilmiştir. Henüz
çok az olan oligomer üretiminin artırılması durumunda daha rahat, güvenli ve çok
sayıda çalışmalar yapılabilecektir. Bu
teknoloji aynı zamanda bazı terapötik ajanların (özellikle, gen tedavisinde, vs)
hücre içinde istenilen yerlere dağıtılmasında ve hedef bölgeye iletilmesinde
yararlar sağlayacağı da açıklanmıştır. Antisens
RNA teknolojisi, süs bitkilerinde pigmentasyonun manipulasyonunda, domates ve şeftali
gibi meyvelerin yumuşamalarının geciktirilmesinde de kullanılabileceği
belirtilmektedir. Antisens
RNA teknolojisi, insan ve hayvanların bazı viral hastalıklarında in vitro düzeyde
yapılan çalışmalarda başarılı sonuçlar elde edildiği belirtilmiştir. Ancak,
deneme hayvanlarında (in vivo) çalışmalar sürdürülmekte ve alınan sonuçlara,
henüz olumlu gözle bakılmamaktadır. Çünkü oluşturulan dubleks tam kesinlik
kazanmıştır. Çünkü, dubleks RNA molekülünün ribosomlarla interaksiyona
girebileceği ve böylece protein sentezini tümden bozabileceği ve ayrıca, çekirdek
içinde oluşan dubleks RNA-RNA molekülünün buradan sitoplazmaya aktarılmasında
güçlüklerin olabileceği, pre-mRNA'dan intronların çıkarılması ve eksonların
birleştirilmesi prosesisini önleyebileceği dubleks molekülün çekirdek içinde mi
yoksa sitoplazmada mı gerçekleştiğinin tam saptanamaması, olgun mRNA'nın
sitoplazmaya ne zaman geçtiğinin belirlenmemesi, oligomerlerin hücre çekirdeğine
girebilme durumlarının ne olduğu ve diğer bazı olumsuzlukların olabileceği gibi
sorunlar da henüz açıklığa kavuşturulmamıştır. Prokaryotik
ve ökaryotik organizmalarda, DNA'ya bağımlı RNA polimeraz enzimi (transkriptaz), DNA'daki promoter bölgesine bağlanarak, iki DNA iplikçiğinin
birinde (sens
karakteri gösteren ve 3' ¬¾¾ 5'
yönünde olanından) bulunan genetik şifreleri aynen (yalnız, timin yerine urasil olmak
üzere) yeni sentezlenen mRNA'ya transferini katalize eder (transkripsiyon). Bu mRNA da 5'¾¾®3' bir
polariteye sahiptir ve kendinin sentezinde kalıp ödevi gören DNA'ya da anti paraleldir. Eğer
bu sentezlenen mRNA'da bulunan genlerden birinin inaktivasyonu isteniyorsa, o zaman, bu
hedef genle komplementer olan ve birleşebilen sentetik
bir antisens RNA sekansları hazırlanarak hücrelere transfer edilir. Bu oligomer
sekanslar hücre içinde kendisine komplementer olan ve istenmeyen sekanslarla birleşerek
(dubleks RNA) onun translasyonuna mani olurlar. Böylece istenmeyen genin aktivasyonu
önlenmiş olur. (Antisens gen, normal
genin mRNA'sına komplementer olan RNA moleküllerin sentezini kodlayan genlere denir).
Antisens gen, hedef RNA'yı kodlayan DNA fragmentlerinin pozisyonuna ters oriyentasyonda,
kuvvetli promotor ile terminatör sekanslar arasına koyarak hazırlanır ve bir plasmide
bağlanarak hücreye transfer edilir. Antisens
RNA molekülü başlıca iki tarzda hazırlanabilmektedir. Bunlardan yaygın olarak
kullanılan, yukarıda bahsedilen sentetik antisens oligomer RNA hazırlama ve kullanma
teknolojisidir. Diğer bir yöntem de, mRNA üzerindeki istenmeyen hedef geni inaktive
etmede, antisens RNA geni kullanmaktır. Böylece, hücre içinde, antisens RNA geni tarafından oluşturulan
antisens RNA molekülünden yararlanılır. Burada bu son teknolojiden kısaca
bahsedilecektir. Bu
yöntemde, hücre DNA'sında bulunan hedef genin polaritesine ters oryantasyonda bir gen
hazırlamak, amaçlanır. Bu tarzda hazırlanan suni gen'e, prokaryotik ve/veya ökaryotik
organizmalar içinde akivite gösterebilen kuvvetli
bir promoter ile terminatör sekanslar
ilave edilerek hücrelere transferi sağlanır. Hücre içinde, genin ekspresyonu,
antisens RNA molekülünün de sentezine neden olur ve mRNA üzerindeki komplementer
sekansla birleşerek onun translasyonuna mani olur. Bu
teknoloji ile üretilen antisens RNA molekülünün, ökaryotiklerde etkinliği hakkında
bazı görüşler de ileri sürülmüştür. Bunlar kısaca şöyledir. 1)
Antisens RNA molekülü, çekirdek içinde hedef DNA sekansları ile hibridize olabilir, Antisens
RNA teknolojisi, insan ve hayvanlardaki bazı viral hastalıkların önlenmesinde başarı
ile denenmiştir. İlerisi için ümit verici bir teknoloji olarak görülmektedir. Bu
teknoloji aynı zamanda, bazı terapötik ajanların (özellikle, gen tedavisinde, vs.)
hücre içinde istenilen yerlere dağıtılmasında hedef bölgeye iletilmesinde yararlar
sağlayacağı belirtilmektedir. Antisens RNA teknolojisinin, süs bitkilerinde
pigmentasyonun manipulasyonunda, domates ve şeftali gibi meyvelerin yumuşamalarının
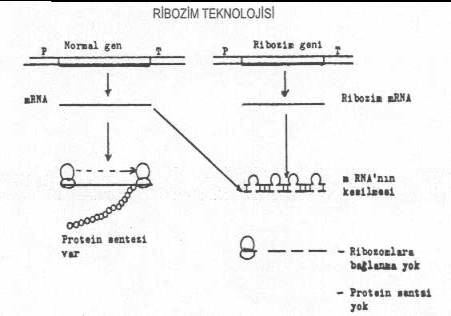
geciktirilmesinde de kullanılabileceği ileri sürülmüştür. 04.05. Ribozimlerle İnaktivasyon Son
yıllara kadar hücrelerde biyolojik olayların katabolize edilmesini sadece proteinlerin
(enzimler) yaptığı düşünülürdü. Diğer bir ifade ile, enzimlerin protein
karakterinde olacakları kabul edilirdi. Ancak, son zamanlarda, bazı RNA moleküllerinin
de enzim gibi aktiviteye sahip olduğu ve reaksiyonları hızlandırabilecekleri ortaya
konulmuştur. Böyle etkinliğe sahip RNA moleküllerine Ribozim (ribozyme, ribonukleik asit enzim)
adı verilmekte, ve bir çok canlı organizmada bulunabilecekleri de belirtilmiştir.
Ribozimlerin çoğu RNA moleküllerini ayrıştırmakta ve özellikle, pre mRNA'dan
intronların çıkarılma prosesinde etkinliği olduğu bildirilmektedir.
mRNA
üzerinde hidrolizan etkiye sahip olan ribozim genleri DNA'dan çıkarılarak buna
kuvvetli bir promoter ile terminatör sekansları ilave edildikten sonra hücrelere etkin
bir tarzda transfer etmek gereklidir. Genin hücre içinde ekspresyonu sonu sentezlenen
ribozimler istenmeyen sekans üzerinde bir çok kesmeler yaparak genin bütünlüğünü
bozar ve translasyonuna mani olur. Ribozim geni, sentetik olarak istenmeyen herhangi bir
hedef sekansa yönelik hazırlanabilir ve kullanılabilir. Sentezlenen ribozim
molekülleri hedef sekans üzerine bağlandıktan sonra ilmekler oluşturur ve mRNA'nın
kesimi de bu ilmeklerin bulunduğu yerde meydana gelir. Bu bölgede, ribozim, mRNA'daki
hedef sekanslara komplementerdir. Bu bölgenin dışında etkili olamazlar. Ribozim
geni verilerek transjenik hale getirilen hayvanlar kendi ribozimlerini üretebilirler. Bu
teknoloji aynı zamanda viruslara karşı dirençli organizmalar meydana getirmede
yararlar sağlayabilir. Viral RNA'ya karşı hedeflenen ribozim genlerinin hücrelere
transferi ve ekspresyonlarının, koruyucu etkisi bulunmaktadır. Ribozim
teknolojisi aynı zamanda peynir endüstrisinde starter kültürleri veya önemli
mikroorganizmaları fajların litik etkisinden korumada da bir role sahip olacaktır.
İleride, kendi ribozimini taşıyan transgenik bitkiler de elde edilebilecektir. 04.06. Rekombinant DNA Teknolojisi ile İnaktivasyon Rekombinant
DNA teknolojisi, biyoteknolojik yöntemlerin en önemlilerinden biridir. Hatta esasını
oluşturur. Bu tekniği uygularken, özellikle, genlerin klonlanmasını yaparken, bir
organizmadan çıkarılan hedef gen, alıcı veya konak bir prokaryotik veya ökaryotiğe
transfer etmeden önce uygun vektörlerden birinde klonlanır. Ancak, bu klonlama
sırasında, genellikle, seleksiyonda önemli fonksiyonu olan genlerin biri inaktive
edilir. Bu genin içine hedef gen sekansları yerleştirilerek genin inaktivasyonu
sağlanır. Bu inaktivite edilen gen, genellikle, antibiyotiklere dirençlilik sağlayan
sekanslara sahiptir. Genin inaktivasyonu, antibiyotiğe organizmayı duyarlı hale getirir
ve bu iyi bir seleksiyon ortamı sağlamış olur. Bu konu
üzerinde "Mikrobiyolojide
Biyoteknoloji"
bölümünde gerekli bilgiler verilmiştir.
04.07. Feedback Mekanizma İle İnaktivasyon Bir
hücre içinde, veya organizmada gen ürününün fazla olduğu durumlarda, bu ürünlerin
tersine bir mekanizma ile genin ekspresyonunu geçici bir süre için azaltması veya
durdurması olayıdır. Buna en iyi örnek olarak, kanda fazla miktarda antikorun
bulunduğu durumlarda uyarım için homolog antijen tekrar verildiğinde yeni bir
stimulasyonun meydana gelmemesi ve antikor titresinde bir artmanın oluşmaması
gösterilebilir. Hücre içinde aminoasitlerin fazla olduğu durumlarda da aynı fenomen
gözlenebilir.
05. Genlerin
İzolasyonu Rekombinant
DNA teknolojisi yardımıyla genleri izole
etmek, üzerinde çalışmalar ve özellikle, genetik manipulasyonlar yapmak olanak
dahiline girmiştir. Genlerin kromozom üzerindeki sayıları, organizmaların türlerine
göre (prokaryotik-ökaryotik) genellikle, 1000 ile 100.000 arasında değişmektedir.
Doğaldır ki bu kadar gen çokluğu arasında istenilen karakterleri taşıyan geni(ler)
bulmak, izole ederek üzerinde gerekli çalışmaları yapmak oldukça zordur. Bu nedenle gen kütüphanesi (gene library) oluşturmak ve genleri burada
toplayarak, gerektiğinde buradan faydalanmak daha kolaylık ve güven sağladığı gibi
zamandan da tasarruf ettirir. Bu
amaca ulaşmak için genomik DNA'lardan yararlanılır. Saf olarak elde edilen genomik
DNA, genlerin büyüklüğünü dikkate alarak uygun bir veya iki restriksiyon enzimi ile
kesilir. Plasmid de virusa (vaccinia) ve faja (lambda) transfer
edilerek buradan alıcı bir hücreye (prokaryotik veya ökaryotik) transfekte edilir.
Prokaryotiklerden, genellikle, E. coli ve
B. subtilis, ökaryotiklerden de maya
(protoplastı) fazlaca
kullanılmaktadır. Alıcı hücrelerde klonlanan genlerle oluşturulan kütüphaneler
gerektiğinde özel işaretli problar yardımıyla
istenilen genler yönünden taranırlar. Genlerin
yerlerini belirlemede veya istenilen geni veya gen ürününü ortaya koymada değişik
yöntemler kullanılmaktadır. Bunlar arasında başlıcaları kısaca şöyledir. 1)
Problarla genlerin yerinin belirlenmesi,
06.
Mikrosatelitler (Minisatelitler) Genellikle
ökaryotik kormozomlarda bulunan, rast gele tekrarlanan (ve genetik informasyon
taşımayan) küçük DNA sekanslarıdırlar (<100 bp). Kolaylıkla amplifiye
edilebilir ve klonlanabilirler. Bu mikrosatelitler insan hekimliğinde babalık
testlerinde, kalıtsal hastalıkların teşhisinde ve genetik haritaların yapılmasında
kullanılabilirler. Mikrosatelitler çiftlik hayvanlarında, verim, büyüme hızı, vs.
parametrelerin saptanmasında da yardımcı olabilmektedir. İnsan
genomunda 4-20 bp uzunlukta 400'den fazla mikrosatelit saptanabilmiştir. İnsanlarda
X-kromozomunda her 300-500 kbp'de bir tane 3-4 nukleotidden oluşmuş mikrosatelite
bulunmaktadır. Bunların hepsi identik değildirler. İnsan
ile fare satelitleri arasında benzerlik bulunduğundan, fareler, insan hastalıklarında
model olarak kullanılabilirler. Mikrosatelitler
insanlarda A, AC, AAN, AAAN ve AG gibi kodlarla belirlenen gruplara ayrılırlar.
07.
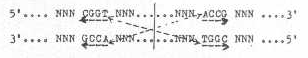
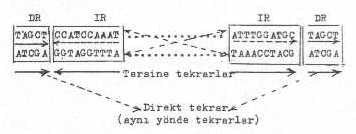
DNA'da Tekrarlar ve Sekonder Yapılar Bazı
DNA moleküllerinde iki kopya halinde identik, birbirine düz (doğru)
veya ters oriyentasyonda kısa sekanslar
bulunmaktadır. Bunlardan birincilerine direkt tekrarlar (direct repeat) ve ikincilere de ters tekrarlar (inverted repeat) adı verilmektedir. Bir DNA
segmentinde veya molekülünde orta eksene göre tersine tekrarlar palindromik sekanslar olarak da
adlandırılmaktadır. Buna, aşağıda örnek verilmiştir. Tersine tekrarlar orta eksene
göre çapraz durumdadırlar. Tersine
tekrarların her zaman birbirlerine komşu olması gerekmez, uzakta da olabilirler.
Çift
iplikçikli lineer DNA'ya sahip olan Lambda fajının iki ucunda da tek iplikçik ve
birbirine tersine baz sıralarına sahip olan ve 12 bazdan oluşan yapışkan uçlar
bulunmaktadır. Ancak, buradaki bazlar birbirinin komplementeri olup gerektiğinde
birleşebilirler. 5' .GGGCGGCG ACCT....../ /.....
..../ /....AGGTCG CCG CCC
.5' Restriksiyon
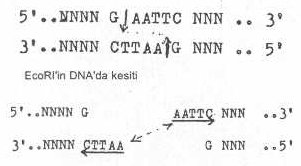
endonukleazlardan olan EcoR1 çift
iplikçikli DNA'larda oluşturduğu karşılıklı kesimlerin sonunda meydana gelen uçlar
da birbirlerinin komplementeri olup yapışkan uç olarak adlandırılırlar (kohezif
uçlar) Ancak, bu tarz
kesimlerde, her bir DNA iplikçiğinde sadece bir tane tersine tekrar vardır.
Oluşan
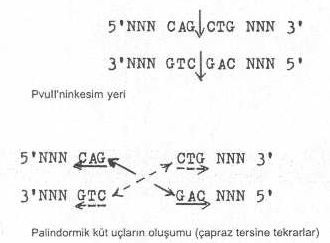
yapışkan uçlar Restriksiyon
endonukleazlardan olan PvII'nin çift
iplikçikli DNA da kesim bölgesinde küt uçlar oluşur ve burada bazlar, orta eksene
göre tersine tekrarlar (palindromik sekanslar)
halindedirler.
Tersine
tekrarlar DNA'da artı (+) benzeri veya birbirine
ters saç tokası gibi sekonder yapılar meydana getirebilirler. Bu durum tek
iplikçik RNA'da ise sadece saç tokası gibi
bir konformasyona neden olur.
Kompozit Transpozonların da her iki uçunda hem tersine tekrarlar ve hem de direkt tekrarlar bulunmaktadır. Örn, Tn 3'ün moleküler yapısı.
[1] Kaynak: Temel Mikrobiyoloji |
||||||||||||