|
Hastalıkların Teşhisinde Biyoteknolojik Yöntemlerin Kullanılması Prof. Dr. Mustafa Arda
Ankara Üniversitesi
Veteriner Fakültesi 01. Genel Bilgiler Bugün,
hekimlik alanında, infeksiyöz hastalıkların tanısında, genellikle, klinik
belirtiler, patolojik ve histopatolojik bulgular, etkenlerin izolasyon ve
identifikasyonları, etkenlere ait antijenik substansların ortaya konulması, immunolojik
yöntemler ile teşhise yardımcı olan diğer testlerden (biyokimyasal, hematolojik,
radyolojik, vs) yararlanılmakladır. Bu konvansiyonel tekniklerde bazı hastalıkların
teşhisi %100e varan bir doğrulukta yapılabilmesine karşın, bir çok
infeksiyonların tanısı da çok zaman almakta, şüpheli veya negatif sonuçlanmakta, ve
bazen de bir teşhis konamamaktadır. Klinik
belirtiler, hastalıkların tanımlanmasında ilk basamağı oluşturmasına karşın,
bazı durumlarda, benzer klinik tablo gösteren ve fakat farklı ajanlardan ileri gelen
hastalıklarda, subklinik ve perakut infeksiyonlarda, infeksiyonların başlangıç
aşamasında, genel belirtilerin bulunduğu olgularda, kronik hastalıklarda, portör ve
rezervuarlarda infeksiyonları tanımlayacak ve ortaya koyabilecek spesifik semptomlar
bulunmamakta ve hatta, bireylerde bir çok faktörlere bağlı olarak farklı, yetersiz ve
hastalığın teşhisine yardımcı olmayan belirtiler ortaya çıkmaktadır. Otopsi
bulguları (makroskopik ve mikroskopik), her zaman spesifik olamamakta ve birçok
infeksiyonlarınki ile benzerlik gösterebilmektedir. Ayrıca, her zaman otopsi olanağı
da olmamaktadır. Bakteriyel
ve viral ajanlardan ileri gelen bazı infeksiyonlarda da spesifik etkeni her zaman izole
ve identifiye etmek mümkün olmamakta, bazı durumlarda etkenin identifikasyonu haftalar
sürmektedir. Bir kısım olgularda da primer etken yerine sekonder mikroorganizmalar
izole edilmekte ve hastalığın teşhis ve sağaltımı da buna göre düzenlenmekte ve
hastaların iyileştirilmesi çok gecikmekte veya mümkün olmamaktadır. Konvansiyonel
immunolojik yöntemlerle bir çok infeksiyonun indirekt teşhisi yapılabilmekte ise de,
bir çok olguda yetersiz kalınmakta ve ayrıca kros reaksiyonlar da ortaya
çıkmaktadır. Bu klasik yöntemlere son zamanlarda ileri serolojik metotlar, özellikle,
immunoassay ler (Radioimmunassay, RIA; Fluorescent immunoassay FIA; Enzyme immunoassay
EIA; İmmun peroksidase testleri, vs.) katılarak hastalıkların teşhisinde daha
güvenli ve erken sonuçlar alınmaktadır. Ancak, bu testler pahalı olduğu gibi
yetişmiş personele ve iyi donatılmış laboratuvarlara gereksinim duyulmaktadır. Bu
kadar duyarlı olmalarına karşı, bazı olgularda da yine kros reaksiyonlar ve şüpheli
durumlar (yanlış pozitif veya yanlış negatif) ortaya çıkmakta ve tanı
gecikmektedir. İnfeksiyonların
erken, kesin ve güvenilir teşhislerinde son 5-10 yıl içinde pratiğe konan
biyoteknolojik yöntemler oldukça yararlı olmuş ve konvansiyonel tekniklerin
boşluklarını doldurmaya ve gidermeye başlamıştır. Bu metotlar başlıca 2 grup
altında toplanabilirler. Bunlar
da: 1)
Etkenlerin genetik materyallerinin saptanması (hibridizasyon yöntemleri), 02. Hibridizasyon Yöntemleri (Genetik
Diagnostik Testler) Hibridizasyon
teknikleri, genellikle, materyallerde (doku, organ, hücre kültürü, ekskret, sekret,
vs.) bulunan hastalık ajanlarının veya bu dokulara ait hücre DNAlarındaki spesifik
genlerin işaretli problarla ortaya konulmasını amaçlar.
Bu nedenle, teknikler Prob hibridizasyon yöntemleri" olarak da
tanımlanmaktadır. Son
yıllarda hibridizasyon tekniklerinde bazı gelişmeler yapıldığından testler daha
kolay, çabuk, etkin ve güvenilir hale getirilmişlerdir. Bunlar arasında en fazla
kullanılan bazı temel hibridizasyon testlerinin prensipleri aşağıda kısaca
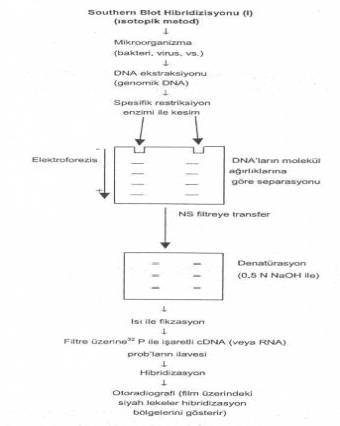
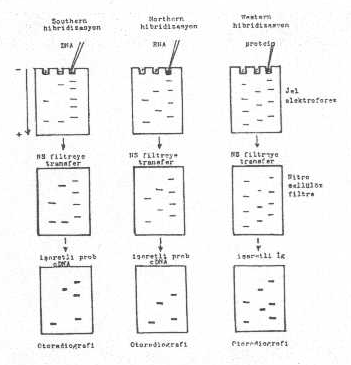
bildirilmiştir. 02.01. Southern Blot Hibridizasyonu Southern
tarafından geliştirildiği için bu adla anılan teknikte, teşhis materyallerinde
bulunan mikroorganizmaların izole ve sonra da pürifiye edilmiş DNAlarındaki
spesifik sekanslar, işaretli problar (DNA veya RNA prob) yardımı ile ortaya konulur. Bu
tekniğin temel aşamaları, kısaca aşağıda gösterilmiştir.
1)
Genomik DNAnın izolasyonu: Patolojik materyallerden mikroorganizmalar (bakteri, virus,
parazit vs.) izole edilir, saf olarak üretilir ve bunların DNAları ekstre edilerek
alınır. Denemelerde, genellikle, saflaştırılmış DNAlar kullanılır.
Mikroorganizmaların DNAlarını elde etmede bir çok yöntemler bulunmaktadır.
Araştırıcılar kendi becerilerine ve laboratuvar olanaklarına göre en uygun
olanlardan birini tercih ederek kullanırlar. Eğer, bakterilerin DNAları
kullanılacaksa, önce mikroorganizmaların hücre duvarları ve dış membranları lize
edilir. Bunun için lizozim ve diğer enzimlerden yararlanılır. Ayrıca, ekstraksiyon
solusyonuna SDS (sodium dodecyl sulphate), proteinaz K ve RNaselarda katılarak, DNA
dışındaki bütün komponentler giderilir. DNAnın endojenik nukleazlardan korunması
için EDTA (bu madde Mg iyonlarını bağlayarak bir çok enzimin aktivasyonuna mani olur.
Çünkü, Mg bir çok enzimin aktivasyonu için kofaktördür) katılır. Ökaryotiklerde,
ekstraksiyon bufferine fenol veya kloroform da ilave edilerek DNAnın proteinlerden
ayrılması sağlanır. Polisakkaridleri gidermek için de Caesium chloride densite
gradient santrifugasyonundan yararlanılır. DNAnın
konsantrasyonu spektrometrik veya elektroforetik yöntemlerin biri ile belirlenir. Ayrıca
saflığı da kontrol edilir. Eğer,
Southern blot hibridizasyon tekniğinde, doku veya organ hücre DNAları
kullanılacaksa, bunlara ait ekstraksiyon yöntemlerinden uygun olanı seçilerek
kullanılır. Plasmid,
faj ve viruslara ait genetik materyalin (DNA) elde edilmesinde ve saflaştırılmasında
kendilerine ait saptanan özel yöntemler tercih edilir. 2)
Spesifik RE ile dijestiyon: Hedef DNA saf olarak elde edildikten sonra, çok az miktarda
(0.5 - 5 µg, bu miktar kullanılan hedef DNAnın türüne göre değişebilir)
alınarak ependorf tüpüne konur. Bunun üzerine, dijestiyonda kullanılacak restriksiyon
endonukleaz enziminden, tam bir dijestiyon sağlayabilecek miktarda ilave edilir ve uygun
bir süre etkilenmesi sağlanır. Böyle enzimler arasında, EcoRl, Hind III, BamHI, vs.
bulunmaktadır. Eğer gerekirse denemede plana uygun olarak iki veya daha fazla enzim de
kullanılabilir (restriksiyon analizlerinde). DNA
suspansiyonu ile enzimler uygun ısıda (genellikle, 37°Cde 4-6 saat kadar)
inkubasyona bırakılır. Bu süre içinde enzim, DNAyı belli bazlardan keserek,
küçüklü-büyüklü çok sayıda DNA segmentleri (fragment) meydana getirir. 3)
Fragmentlerin elektroforezisi: Dijeste DNA solusyonunu agarose jele (PAGE' de olabilir)
uygulanarak uygun bir süre, bazen bir gece 40-50 volt altında elektroforeze tabi
tutulur. Bu separasyon sırasında fragmentler büyükten küçüğe doğru bir sıralama
ile bantlar oluştururlar. Büyükler başlangıç yerinde, küçük segmentler de karşı
uçta lokalize olurlar. Kullanılan cereyanın şiddeti, jelin kalınlığına göre
ayarlanır. Bu
aşamada jel üzerinde oluşan bantlar ethidium bromide ile boyanarak U V-ışınları
altında görüntülenebilir ve bantlar, standart bantla karşılaştırılarak
değerlendirilirler. Eğer başlangıçta iyi bir dijestiyon (kesim) yapılmışsa 20 kb
dan büyük 100e yakın bant meydana gelebilir. DNAlardaki
farklılıkları ortaya koymada, restriksiyon analizleri yapmada, RFLP veya RAPD gibi
tekniklerde agarose jel yanı sıra PAGE (poliakrilamid jel elektroforezis) de
kullanılabilir. 4)
Bantların membran üzerine transferi (Southern transfer): Agarose jel (veya PAGE) üzerinde bulunan bantların naylon veya
nitroselüloz membran üzerine transferleri yapılır. Bu işlem, elektro transfer, alkali
kapillarite veya diğer geliştirilmiş yöntemlerin biriyle kolayca yapılabilir.
Nitroselüloz membran yerine, yakın zamanlarda naylon membranlar daha fazla tercih
edilmektedirler. Bunun başlıca nedenleri arasında, naylonlar daha sağlam, birim alanda
daha fazla DNA adsorbsiyonu sağlamakta, DNAnın fikzasyonu daha kuvvetli olmakta ve
bir membran iyice yıkanıp temizlendikten sonra tekrar kullanılabilmesi olanağı
bulunmaktadır. Aynı zamanda, pozitif yüklü olanlar alkaline transferine ve DNAnın
fikzasyonuna da çok uygundurlar ve yüksek sensitivite de sağlarlar. Elektro transfer
tekniği ile, DNA aktarım işlemininin süresi bir geceden, 1-3 saate kadar indirebilir. 5)
Denatürasyon ve fikzasyon: Naylon üzerine transfer edilen DNA bantları kurutulur ve 0.5
N NaOH ile muamele edilerek denatüre edilir (çift iplikçik DNA, bazlar arası bağlar
koparak tek iplikçik hale gelir). Bu aşamadan sonra naylon membran, 80°Cye kadar
ısıtılarak, tek iplikçiklerin membran üzerine fikze edilmesi sağlanır. Fikzasyonu
sağlamlaştırmak için tespit işlemi vakum içinde yapılır. Son
zamanlarda gerek denatürasyon ve gerekse fikzasyonda daha değişik metotlar da
kullanılmakladır. 6)
Hibridizasyon: Naylon membran önce, pre hibridizasyon solusyonu içinde 60-65°Cde 2-4
saat kadar bulundurulduktan sonra yıkanır. Eğer bu ön muamele yapılmazsa, problar
tüm membran üzerine bağlanarak filmin tüm siyah görünmesine neden olur. Bu aşamadan
sonra, membran üzerine işaretli DNA prob (veya RNA prob) ilave edilir. Problar
32P
(veya biotinle) işaretli olabilir. Membran üzerine konulan tek iplikçik ve işaretli
prob, kendine komplementer olan tek iplikçik hedef DNA segmenti ile non kovalent
bağlarla karşılıklı olarak birleşir ve çift iplikçik DNA x DNA dubleksi (eğer RNA
prob kullanılırsa DNA x RNA dubleksi) oluşur (hibridizasyon). Bu işlem bir gece kadar
sürdükten sonra, membran yıkanarak, birleşmemiş olan tek iplikçik hedef DNA
sekansları ve bağlanmamış olan tek iplikçik problar giderilir ve böylece membran
üzerinde sadece çift iplikçik sekanslar kalmış olur. 7)
Otoradyografi: Naylon membran üzerine, X-ışınlarına duyarlı bir film (Kodak XAR-2)
kapatılarak -70°Cde bir gece tutulur ve radyoaktivitenin film üzerine etkilemesi
sağlanır. Bu
sürenin sonunda film banyo edilir. Bu film üzerinde, işaretli problarla birleşmiş
hedef DNA sekanslarının bulunduğu bölgeler siyah renkte görülürler. Bu bölgeler,
aranılan etkene ait spesifik genin lokalize olduğu yerleri ifade eder. Böylece,
aranılan hedef gen bulunur ve teşhis konulur. Eğer
Probları işaretlemede biotin kullanılmışsa, avidin, peroksidaz ve kromojen madde
yardımı ile oluşan renk değişikliği, aranılan hedef DNA segmentinin bulunduğu
yerleri gösterir. Yukarıda
aşamaları anlatılan Southern blotting tekniğinde
de yine iyi yetişmiş teknik
elemana,çok fazla ve duyarlı malzemeye ihtiyaç duyulduğu gibi, en önemlisi spesifik
etkenin izolasyonuna ve saf olarak üretilmesine gerek vardır.Bu da zaman alan ve klasik
yöntemlerle gerçekleştirilen önemli bir ön aşamadır. Ayrıca, kros reaksiyonları
önlemek için, probların çok spesifik olmaları da önemlidir. 02.02. Northern Blot Hibridizasyon Bu
teknik genelde, Southern blotting yöntemine benzer. Ancak, DNA yerine mRNA, viral RNA
veya total RNA kullanılır. Buna göre, RNAnın agarose jel üzerinde separasyonu,
filtreye transferi, spesifik probla (RNA veya DNA) hibridizasyonu ve otoradyografisi,
Northern Blot Hibridizasyonu olarak adlandırılır.
Bu teknik, genlerin transkripsiyon düzeyinde iken analizlerini yapmada, doku veya
organlardaki mRNA seviyesini belirlemede ve viral RNAlar arasındaki farkı saptamada
yarar sağlar. Southern
blottinge benzeyen bu teknikte RNAların restriksiyon enzimleri ile kesimi işlemi
yoktur. Bu nedenle de yöntemde önemli bir ekonomi ve zaman tasarrufu sağlanmaktadır. Northern
blot hibridizasyonunun başlıca aşamaları aşağıda verilmiştir. 1)
RNAnın izolasyonu (total sellüler RNA, mRNA, viral RNA, vs.) Gerek
total sellüler RNAyı ve gerekse diğerlerini (mRNA, viral RNA) izole etmede ve
saflaştırmada bir çok laboratuvar yöntemleri geliştirilmiş ve kullanılmıştır.
Hepsinde de önemli olan nokta, RNAların DNA ile kontaminasyonunu önlemek ve bunun
için de gerekli tedbirleri almaktır. RNAlar, DNAdan selektif olarak lithium
chloride veya sodium acetate ile presipitasyon yöntemiyle çöktürülerek
ayrılabilirler. İzolasyon, muhafaza ve diğer işlemler sırasında, RNAların RNase
ile kontaminasyonuna azami dikkat edilmelidir. RNase ısıya dayanıklı olduğundan ve
kofaktöre de ihtiyaç göstermediğinden, aktivitesi kolaylıkla giderilemez. Bu nedenle
özel tedbirlerin alınmasına gerek vardır. Ekstre
edilen RNAnın saflığı ve konsantrasyonu iyice belirlenmelidir. RNA
moleküllerini agarose jelde separasyonundan önce restriksiyon enzimi ile kesime gerek
yoktur. Jele de herhangi bir denatüran madde konulmayabilir. Ancak, tek iplikçik RNA
molekülünün sekonder yapısı (kendi üzerine katlanması) jeldeki hareketini
kısıtlayabilir. Bunu önlemek için agarose jele denatüranlardan birinin (formaldehid
veya glyoxal) katılması gerekir. Ancak, daha avantajlı olması nedeniyle, genellikle,
formaldehid tercih edilmektedir. Northern
blotting tekniğinin diğer işlemleri, aynen, Southern blotting de olduğu gibi
yürütülür ve değerlendirilir. Eğer
istenirse, mRNA veya viral RNA, reverse transkriptase enzimi yardımı ile komplementer
DNA (cDNA)ya çevrilerek Southern blot tekniği uygulanabilir. Bu
teknik de, aynen Southern blotting de olduğu gibi zaman alıcı ve bir çok ön işleme
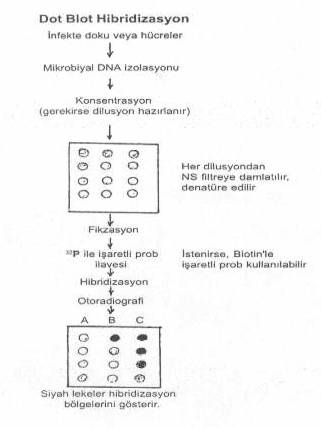
ve teknik aşamalara ihtiyaç duyulmaktadır. 02.03. Dot Blot Hibridizasyonu Bu
yöntemde, genomik DNA segmentleri hibridizasyondan önce elektroforetik bir separasyona
tabi tutulmaz. Patolojik materyallerden mikrobial nukleik asit ekstre edilerek
çıkarılır ve konsantre edilirler. Gerekirse birden fazla klinik materyal kullanılır
ve bunların nukleik asitleri de ayrı ayrı ekstre ve konsantre edilir. Bu aşamadan
sonra örnekler iki veya 5 katlı olarak dilue edilir. Her örneğe ait dilusyonlardan
naylon veya nitroselüloz membran üzerine birer damla damlatılır. Burada denatürasyona
tabi tutularak membran üzerine fikse edilirler. Üzerlerine 32P
ile işaretli spesifik tek iplikçik problar ilave edilir. Bu aşamadan sonraki işlemlere
aynen Southern blotting de olduğu gibi devam edilir.
Film
üzerinde oluşan koyu lekeler hibridizasyon bölgelerini ve dolayısıyla de aranan DNA
sekanslarını veya mikroorganizmalara ait spesifik bazları gösterir. Eğer
problar biotinle işaretlenmişse, reaksiyon, renklerin görünümüne göre
değerlendirilir. Bu
yöntem biraz daha basitleştirilmiş olmasına karşın yinede bir çok ve spesifik
aşamaları bulunmaktadır. Ayrıca, diğer iki teknikte de olduğu gibi, bunda da en
önemli nokta, izole edilen ve DNA'sı ekstre edilen etkenlerin primer etken
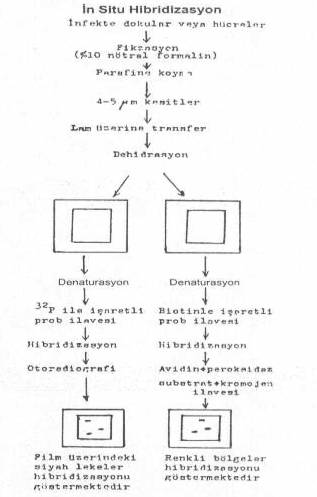
olmalarıdır. 02.04. İn Situ Hibridizasyon Bu
teste infekte doku kültürleri, biyopsi materyalleri, doku süspansiyonları, periferal
kan vs. den bir damla lam üzerine konur. Denatürasyondan sonra işaretli (32P,
biotin-avidin, vs.) cDNA prob ilave edilerek hibridizasyon sağlanır.
Mikroorganizmaların DNAlarının bulunduğu yerler kolayca belirlenir. Test
doku kesitleri ile de yapılabilir. Örn., infekte akciğer dokusu nötral formalinli
buffer içinde fikse edilir, parafinlenir ve ince kesitler (5 mikrometre kalınlık)
yapılır. Kesitler parafinleri giderildikten ve
dehidre edildikten sonra temiz bir lam üzerine yerleştirilirler ve üzerine biotinle
işaretli cDNA prob konur ve her ikisi birden denatürasyona tabi tutulur (90°Cde 5
dakika). Karışım 37°Cde 18-24 saat tutularak hibridizasyon sağlanır. Sonra ortama
avidin-biotin peroksidaz kompleksi katılır ve renk değişimi olan bölgeler aranan
mikroorganizma DNA segmentlerinin bulunduğu yerlerdir.
03. İmmunojenik Substansların
Saptanması (Moleküler Diagnostik
Testler) Hastalık
ajanlarının ve özellikle, bunlardan elde edilen antijenik substansların (protein,
glikoprotein, vs.) ortaya konmasında biyoteknolojik yöntemlerden büyük ölçüde
yararlanılmaktadır. Bunlardan bazılarının prensipleri ve adları aşağıda
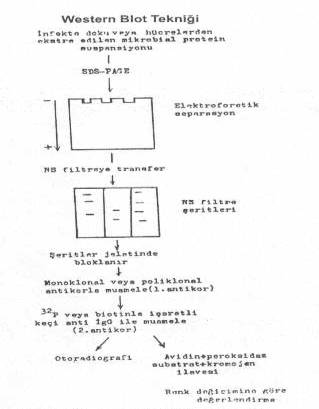
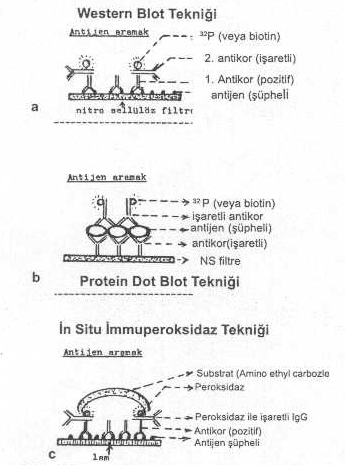
belirtilmiştir. 03.01. İmmuno (Western) Blotting Bu
teknik, mikroorganizmaların yapılarında bulunan antijenik proteinlerin saptanmasında
kullanılmaktadır. Virusların veya bakterilerin proteinleri saf olarak elde edildikten
ve SDS ile muamele edildikten sonra SDS-poliakrilamid jel elektroforeziste molekül
ağırlıklarına göre bir separasyona tabi tutulurlar. Bu işlemlerden sonra, elektro
transferle nitroselüloz kağıtlarına aktarılır. Havada kurutulur (gerekirse
-20°Cde muhafaza edilir). Kağıt şeritler, poliklonal veya monoklonal antikorlarla
muamele edilerek, antikorların proteinlerle (antijenle) birleşmesi sağlanır. Kağıt
şeritler yıkandıktan sonra, üzerlerine, birinci antikorlara karşı hazırlanmış ve
işaretlenmiş (32P,
biotin vs.) keçi anti İgG spesifik antikorları konur .
Eğer
testte 32p
ile işaretli antikorlar kullanılmışsa sonuç otoradiografik yönteme göre veya
biotinli antikor kullanılmış ise avidin-peroksidaz konjugatı, 4-chloro-1-naphtol
substratlı ilave edilerek renk değişikliğine göre değerlendirme yapılır. Test
aynı zamanda antikorların saptanmasında da kullanılır. 03.02. Protein Dot Blot Deneyi Bu
denemede teşhisi istenen hedef mikroorganizmaya karşı hazırlanmış olan spesifik
monoklonal antikorlar nitroselüloz kağıtlarına konur ve 10-15 dakika kurutulur
(gerekirse jelatinde bloklanır). İnfekte dokulardan hazırlanan mikroorganizmalara ait
süspansiyonların (protein antijen) supernatantları, filtre kağıdında kurutulmuş
olan antikorların üzerine damlatılır ve 2 saat kadar etkileşimi sağlanır
(antikor-antijen konjugatı). Filtre yıkandıktan sonra infeksiyöz ajana karşı
hazırlanmış ve biotinle işaretlenmiş antiserum, kağıttaki konjugat üzerine
damlatılır ve 2 saat inkube edilir ve yıkanır. Sonra, reaksiyonu oluşturmak için
avidin enzim konjugatı ve substratı ilave edilir. Renk durumuna göre sonuç
değerlendirilir.
03.03. İn Situ Immunperoksidaz Deneyi Bu
testte, formalinle fikse edilmiş infekte doku kesitlerinde poliklonal veya monoklonal
antikorlar kullanılarak. bakteriyel veya viral proteinler saptanır. Kesitler, Spesifik
antikorlarla inkube edildikten sonra da substrat olarak amino ethyl-carbazole katılır.
Dokularda bulunan mikrobial proteinler renk değişikliğine göre saptanırlar.
[1] Kaynak: Temel Mikrobiyoloji |
||||||||||||||||