Nukleik Asitlerin İn Vitro Amplifikasyon YöntemleriProf. Dr. Mustafa Arda
Ankara Üniversitesi
Veteriner Fakültesi
01. Giriş 01. Giriş Nukleik
asitlerin (DNA veya RNA) in vitro amplifikasyonları (sayısal çoğaltılması),
patojenlerin ve dolayısıyla da infeksiyonların, tümörlerin, genetik hastalıkların
teşhisinde ve adli tıpta, en fazla kullanılan yöntemlerin arasında yer almaktadır. Amplifikasyon
yöntemlerinde, çeşitli organ, doku ve sıvılardan izole edilen genetik materyaller
veya sekanslar enzimatik olarak çoğaltılır. Sayısı artırılan genetik ürünler
(amplikon), ya homolog işaretli problar
kullanılarak hibridizasyonla, veya elektroforezis ve boyamadan sonra direkt
görüntülenerek ortaya konulurlar. Amplifikasyon
teknikleri, katı ortamlarda bakterilerin çoğalarak görülür hale gelmesi (koloni
oluşturması) ile özdeşleştirilebildiği gibi, patojenlerin (veya antijenlerin)
vücuda girdikten sonra oluşan spesifik antikorların ortaya konmasıyla de benzerlik
gösterir. Şöyle ki, vücutta, çok az miktarda antikor bulunabilir bunlar bazı özel
immunolojik testlerle (ELİSA, İFA, RİA, vs.) belirlenebilirler, aynen vücutta çok az
sayıda genetik materyallerin amplifikasyon yöntemleriyle saptanabilmesi gibi. Ayrıca,
vücutta hiç bir hastalık oluşturmadan veya antikor sentezini uyarmadan bulunabilen
fakat başka bireyler için patojenik olabilen mikroorganizmaları, latent, gizli, kronik
infeksiyonları, portör, rezervuar ve nesli tükenmiş hayvanları saptamada
amplifikasyon teknikleri daha güvenilir ve çabuk sonuçlar vermekte ve epidemiyolojik
çalışmalara büyük kolaylıklar sağlamaktadır. Ancak, genetik materyallerin,
vücutta immun responsun meydana gelmesinden veya tedaviden sonra ne kadar süre sonraya
kadar kalabildiği ve teşhis için işe yarayabileceği henüz tam belirlenmiş
değildir. Ancak, şunu da belirtmek gerekir ki, donmuş fosillerden elde edilebilen
genetik materyaller amplifikasyonda kullanılabilmekte ve genetik materyaller uzun yıllar
bozulmadan kalabilmektedirler. Amplifikasyon
yöntemlerinin çabuk, güvenli, sensitif ve spesifik olmaları, kandaki antikorlardan,
materyallerin eskiliğinden, etkenlerin vücutta çok az sayıda veya inaktif
olmalarından etkilenmemeleri nedeniyle, izolasyonları, üretilmeleri veya
identifikasyonları çok zor olan bakteriyel ve viral ajanların belirlenmesinde büyük
yararlar sağlamaktadır. Bu teknikler, ayrıca, zamandan ve personelden büyük tasarruf
sağlamasına, personel hatalarını ve laboratuvar infeksiyonlarını minimal düzeye
indirmesine karşın, halâ, pahalı, deneyimli ve bilgili personele, gelişmiş
malzemeye, saf kimyasal maddelere, işaretli problara, enzimlere, spesifik primerlere vs.
gereksinim vardır. Aynı zamanda, vücutta, herhangi bir infeksiyon oluşturmayan
mikroorganizmalar (apatojenik, kontaminantlar, vs.) kros reaktif olarak tespit
edilebilmekte, sonuca ve yorumlamaya ters yende etkilemektedirler. Laboratuvarlarda
aseptik ve/veya steril koşullara uyulmadığı durumlarda kontaminasyonlar (amplifiye
olmuş DNA sekansları ile) fazla olmakta ve fazla kullanılan pipet, solüsyon, reagent,
kimyasal vs. de bulaşmalar görülmektedir. Bunlar da, işaretli problar, veya primerler
aracılığı ile amplifiye olmaktadırlar. Bunların yanı sıra, serolojik, kültürel,
klinik, biyopsi ve otopsi bulguları negatif olan bir olguda sadece amplifikasyon
yöntemleriyle alınan pozitif reaksiyonun değerlendirilmesi veya yorumlanması da
oldukça zordur. Şunu
da unutmamak gerekir ki, amplifikasyon yöntemleri, hiç bir zaman direkt teşhis
metotları değildir. Bunlar tanıya büyük yardımı ve desteği olan çok duyarlı,
sensitif, çabuk ve güvenilir testlerdir. Bu üstünlüklerine karşın, amplifikasyon
prosedürlerinin, belirtilen bazı dezavantajlarından dolayı, bazı araştırıcılar,
diğer kolay ucuz ve duyarlı klasik laboratuvar teknikleri denendikten sonra, şüpheli
veya sonuç alınamayan olgularda, kullanılmasının yerinde olacağını
bildirmektedirler. Amplifikasyon
yöntemlerini 3 grupta incelemek yerinde olur. 1)
DNAnın amplifikasyonu Bu
bahiste sadece grup-1 işlenecektir. 02. DNA Amplifikasyon Teknikleri Bu
teknik, klinik materyallerde bulunan veya izole edilen etkenlere ait DNAların veya
bazı spesifik sekansların in vitro olarak enzimatik amplifikasyonlarını amaçlar.
Pratikte de, bu DNA amplifikasyon yöntemi, diğerlerine oranla daha fazla uygulama alanı
bulmuştur. RNA karakterindeki genomik materyaller de önce, revers transkriptaz (RT) ile
komplementer DNAya (cDNA) çevrilerek amplifikasyonu yapılır. DNA
amplifikasyonunun en yaygın ve önemlisini Polimeraz Zincir Reaksiyonu (PZR)
oluşturmaktadır. Bu nedenle teknik hakkında aşağıda gerekli bilgiler verilmektedir. 03. Polimeraz Zincir Reaksiyonu(PZR)(Polymerase Chain Reactıon,
PCR) Son
yıllarda, özellikle, 1980li yılların başından itibaren, genetik materyaller
üzerindeki çalışmalar, nukleik asit karakterizasyonunda, moleküler klonlamada, sekans
analizlerinde, rekombinant teknolojisinde ve klinik uygulamalarında nukleik asit tabanlı
problardan yararlanma olanakları giderek artmıştır. Ayrıca, prokaryotik ve
ökaryotiklerin genomlarındaki modifikasyonlar, restriksiyon analizleri ve sistemleri
üzerinde de son zamanlarda yoğun çalışmalar yapılmaktadır. Saiki ve ark. (1985)
tarafından, mevcut yöntemlerin duyarlılıkların artırılmasından ziyade, DNA veya
RNA baz sıralarının sayısal olarak artırılması (amplifikasyon) teknolojisine
dayanan ve dolayısıyla de mevcut yöntemlerle analiz edilebilmelerini sağlayan,
Polimeraz zincir reaksiyonunu (PZR) geliştirmişlerdir. PZRın
geliştirilmesi, moleküler teknolojinin ve aynı zamanda, kullanım alanının da
genişlemesine yol açmıştır. PZR, son yıllarda, biomedikal araştırmalar yanı sıra
infeksiyöz ajanların teşhisinde, epidemiyoloji, genetik defektlerin saptanmasında,
adli tıp ve diğer alanlarda da geniş bir uygulama ortamı bulmuştur.
03.01. PZRnin Çalışma Prensibi Bir
çok disiplinde olduğu gibi, insan ve veteriner hekimlikte de çok büyük yararlar
sağlayan PZRın çalışma prensibi, oldukça basittir. Özet olarak, izole edilen
veya patolojik materyallerde bulunan hedef genetik materyallerin (DNA veya RNA), spesifik
kısa zincirli oligonukleotid primerler yardımı ile, enzimatik olarak sayısal
çoğaltılması (amplifikasyon) olarak tanımlanabilir. Bu hedef genetik materyal çok az
sayıda ve hatta, bir çok veya sayısız diğer veya ilgisiz DNAlar arasında olsa
bile çoğaltılabilir ve homojen bir DNA materyali haline getirilebilir ve kolayca da
identifiye edilebilir. PZR
küçük volumler halinde hazırlanır. Şöyle ki, 0.5 ml mikrofüj tüpüne 100 µl.
hacimde materyal konur. Bu materyaller arasında, 1)
Aranan hedef DNA sekansları, 2)
İki tür spesifik oligonukleotid primerleri (15-30 bazlık, tek iplikcikli), 3)
Termostabil DNA polimeraz (Taq polimeraz veya diğerleri) 4)
Dört tür dNTP (dATP, dCTP, dGTP, dTTP) bulunur.
Bu
ön hazırlıklar tamamlandıktan sonra, PZR başlıca 3 aşamada gerçekleştirilir.
Bunlar da, 1)
Hedef DNAnın denatürasyonu: Bütün gerekli materyaller çok küçük miktarlarda
mikrofüj (Ependorf, vs.) tüplerine konduktan sonra özel bir aletin (Thermal cycler)
gözlerine yerleştirilir. Alet otomatik olarak ısıyı 95°Cye yükselterek bu
ısıda hedef DNAların denatürasyonu (nukleik asitin iki iplikçiğinin
birbirlerinden ayrılarak tek iplikçik haline gelmesi) sağlanır. Bu işlem için,
materyalin türüne göre değişmek üzere 3-5 dakika kadar bir süre yeterli
olmaktadır. 2)
Primerlerin bağlanması: Ayarlanmış olan süre sona erdikten sonra, alet ısıyı,
50-52°C ye indirerek ortamda bulunan iki tür primerin, her birinin komplementeri olduğu
tek iplikçik hedef DNA üzerindeki spesifik sekanslara bağlanması gerçekleştirilir.
Şöyle ki, primerlerden biri kendine ait 5'-terminusu ile hedef DNAlardan birinin
3'-ucu ile ve diğer primerler de, ikinci tek iplikçik DNAnın, antiparalel olan
diğer ucunda bulunan 3'-ucuna bağlanarak, DNA polimerazın çalışma yönüne uygun
olarak (5' ®3')
bağlanırlar. Bu işlemlerin tamamlanması da yaklaşık yine 3-5 dakika kadar devam
eder. 3)
Polimerizasyon: Bu bağlanma süresi bitince aletin ısısı hemen 70- 72°Cye
çıkarak, tüpler içinde bulunan ve ısıya dayanıklı olan Taq polimeraz enzimi, 5®3
yönünde olmak üzere, ortamdaki nukleotidleri kullanarak, primerlerin 3'-terminusuna
nukleotidleri yerleştirir ve böylece hedef DNA sekansının bir kopyası elde edilir.
Polimerizasyon reaksiyonunda, hedef DNAnın tek iplikçik sekansları kalıp ödevi
görür. Bu süre de yaklaşık 3-5 dakika sürmektedir. Böylece,
PZRın 3 aşamadan oluşan ve yaklaşık olarak 10-15 dakika kadar devam eden birinci
amplifikasyon aşaması, tekrar ısının 95°Cye yükseltilmesi ve aynı aşamaların
25-30 kez tekrarlanması durumunda tek bir hedef DNA segmenti, 2n formülüne göre,
yaklaşık 33.6 milyon çoğaltılmış olur. Ancak, deney koşullarında gerçekleşen
verim oranı %85 kadardır. Bunda esas faktörü, dönem sayısı arttıkça verimin
düşmesi oluşturmakta, enzimin tanıması gereken nukleotidlerin sayısının fazla
olması, tekrarlanan ısı değişiklikleri ve artışların da enzimin aktivitesine
olumsuz etkilemesinin önemli rolleri bulunmaktadır. Taq polimeraz enziminin yaklaşık,
her 1000 nukleotidde bir nukleotid kadar hata yapması, sentezlenen yeni cDNAya
yanlış nukleotidlerin girmesine de yol açmaktadır. Hata oranı (m), m=2f/c formülü
ile hesaplanmaktadır (burada f: nukleotidlerin zincire katılmasındaki hata ve c: ise
dönem sayısı). PZRnın
istenilen doğrultuda devam etmesinde reaksiyon tüplerine konan primerlerin ve
dNTPların sayılarının ve her aşamada uygulanan sürenin çok önemli rolleri
bulunmaktadır. Bu süre hedef DNAnın türüne göre 3-5 dakika arasında
değişebileceği ancak süre ayarlamada araştırıcıların bilgi ve beceri
düzeylerinin de katkılarının fazla olacağını unutmamak gerekir. Termostabil
Taq polimeraz veya diğer termostabil enzimler, bilinçli olarak seçilmelidirler.
Başlangıçta enzimin bir defa ve 25-30 siklus için yeterli olabilecek miktarda
katılması da önemlidir. 03.02. Polimeraz Enzimleri Orijinal PZR
teknolojisinde, ilk önceleri, E.coli ' den izole edilen DNA
polimeraz enzimi kullanılmıştır. Bu enzim termolabil olduğundan ısının 95°Cye
çıkarılması halinde, enzim inaktive olmaktaydı. Bu dezavantajı gidermek için, her
periyodda yeniden enzim katılması zorluğu, ısıya dayanıklı enzimin bulunması
gereğini ortaya koymuştur. İlk termostabil DNA polimeraz, Thermus aquaticusdan
izole ve pürifiye edilmiştir (110 kD, Taq polimeraz). Bu mikroorganizma Yellow Stone
Ulusal Parktaki sıcak su kaynaklarından izole edilmiştir. Taq polimerazın 95°Cdeki
yarı ömrü yaklaşık 40 dakika kadardır. Bunun, 61 kDluk StoffeI fragmentinin daha
yüksek ısıya dayanıklı olduğu açıklanmış ve G + Clerden zengin bazlara sahip
hedef DNAların amplifikasyonunda daha etkili olduğu belirtilmiştir. Bu fragment
aynı zamanda geniş bir Mg iyon konsantrasyonununda (2-10 mM) aktivite
gösterebilmektedir. Böyle bir durum, aynı reaksiyon tüpünde, 2 veya daha fazla
farklı (veya değişik) hedef DNA sekanslarını da aynı reaksiyon ortamında
amplifikasyonuna olanak sağlamaktadır (multipleks PZR). Son
yıllarda, bir çok termostabil polimeraz enzimi izole, identifiye, pürifiye edilmiş ve
denenmiştir. Bunlar arasında, Thermococcus literalis den izole edilen Vent
polimeraz, Thermus thermophilus dan Tth polimeraz ve Pyrococcus furiosus
dan da Pfu polimeraz enzimleri elde edilmiştir. Bu 3 termostabil enziminin birbirinden
ve Taq polimerazdan bazı üstünlükleri bulunmaktadır. Örn., Taq polimerazın 3' ®
5' ekzonukleaz aktivitesi bulunmamaktadır. Bu durum, DNAnın amplifikasyonu
sırasında yanlış bazların sıraya girmesi halinde (her 1000 bazda bir baz) bunları
tanıyarak çıkaramamakta, böylece sentezi sürdürmekte ve uygun olmayan bir
polimerizasyona yol açmaktadır. Bu yanlış bazların sıraya girme problemi, ortama
katılan baz sayısının ve Mg Cl iyon konsantrasyonunun azaltılması ile giderilmeye
çalışılmıştır. Vent polimeraz enziminin tashih etme (3'®5'
ekzonukleaz aktivite, yanlışlıkları düzeltme) özelliği bulunmakta, ortamda fazla
dNTPların ve Mg Cl iyonların bulunması durumunda, Taq polimerazdan daha iyi bir
etkinlik göstermektedir. Ayrıca, bu enzimin yarı ömrü de daha uzundur. Tth
polimerazda çok spesifik olup DNAya bağımlı DNA polimeraz aktivitesi yanı sıra,
RNAya bağımlı DNA polimeraz aktivitesi de (revers transkriptaz) bulunmaktadır. Bu
yönden Tth polimerazın Taq polimeraza üstünlüğü bulunmaktadır. Pfu polimeraz
enzimi de termostabil olup optimum aktivitesi 75°Cdedir. DNA sentezleme kapasitesinin
Taq polimerazdan 12 kez daha fazla olduğu ve ayrıca hata yapma olasılığının ise
daha düşük olduğu açıklanmıştır. Ancak, yüksek ısı yönünden etkinliği, Taq
polimerazdan daha geride kalmaktadır. 03.03.
Hedef DNA Kaynakları PZR
için her türlü kaynaktan temin edilen DNA (veya RNA) kullanılabilir. Kan, serum,
vücut sıvıları, dokular, organlar, fikse edilmiş dokular, vs. çok fazla
yararlanılan materyaller arasındadır. PZRnin çok duyarlı olması, çok az
miktarlardaki örneklere gereksinim duymaktadır. Örn., tek bir saçtan elde edilen
hücre(ler)den sağlanan genomik DNA yeterli olabilmektedir. Ayrıca, örneklerden elde
edilen DNAların da pürifiye edilmelerine gereksinim yoktur. Bu nedenle de hedef
örneklerin hazırlanmasında deterjanlar (Nonidet P40, Tween 20 ve/veya Triton X100, vs.)
veya Chelating ajanlar hücre membranlarının parçalanmasında kullanılabilirler.
Proteinaz Kden de sellüler proteinlerin ayrıştırılmasında
yararlanılabilmektedir. Her
ne kadar bazı organik solventler (fenol, kloroform, vs.) amplifikasyon üzerine zararlı
etkisi olmadığı bildirilmişse de kullanılırken iyi bir seçim yapılmalıdır. Kan
veya deparafinize edilmiş dokular, histolojik, patolojik, metabolik, tarihsel
materyaller, PZR ile amplifikasyonda kullanılabilirler. 03.04. Primerlerin Seleksiyonu Sentetik
olarak kolayca hazırlanabilen tek iplikcikli spesifik DNA segmentleri olan primerler,
kullanılma amaçlarına göre, 15-40 oligonukleotidden oluşmuşlardır. Bunlar, hedef
DNA üzerinde kendine komplementer olan baz sıralarını bularak onlara bağlanır ve
buradan (3'-OH terminus) DNA sentezinin ilerlemesine basamak teşkil ederler. Primerlerin
yapısında, % 50-60 kadar G + C bazların bulunması, hedef DNA ile daha kuvvetli
bağların kurulmasına yardımcı olur. Ayrıca, böyle birleşmeler, yüksek ısıda
oluşturulan amplifikasyonda nonspesifik bağlanmaları da azaltır. Primerlerin 3'-ucundaki bazların, hedef DNAnın kopyasının çıkması işlemini başlatmada, önemleri fazladır. Bu nedenle primerlerin 5'-ucu, hedef DNAnın 3'-ucu ile birleşerek, polimerizasyon için 5' ® 3' yönünde uygun bir ortam yaratmaktadır. Yeni bazlar, primerin 3'-terminusuna, kalıp DNA örnek alınarak seçilir ve ilave edilirler. Bu uçtaki tek bir uyumsuzluk polimerizasyonun etkinliğini azaltır.
Primerler
o tarzda seçilmeli veya hazırlanmalıdırlar ki, kendilerinde bulunan baz sıraları,
sadece hedef DNA üzerinde bir bölgede bulunmalı başka yerlerde veya başka hedef DNA
sekanslarında bulunmamalıdır. Eğer bu kurala uyulmazsa, kros amplifikasyonlar meydana
gelerek sonuca ve yorumlamaya olumsuz yönde etkilerler. Bu nedenle, her ne kadar ön
koşul olmamakla beraber, hedef DNAnın saf olmasının büyük yararları
bulunmaktadır. Diğer önemli bir noktada, hedef DNA baz sıralarının çok iyi
bilinmesi ve bunlar üzerindeki spesifik bölgelerin seçilmesi ve başka bir ajanda
bulunmamasına gayret gösterilmelidir. Böyle
yanlışlıkları önlemek için, kullanılmadan önce primerlerin spesifiteleri, rutin
muayenelerle denenmeli uygun bulunanlar testte kullanılmalıdırlar. Primerler
yanı sıra reaksiyon ortamına katılan nukleotidler ve solüsyonların da dikkatle
seçilmesi ve kullanılmasına azami özen gösterilmelidir. Bunlar, kesinlikle, kontamine
olmamalıdırlar. 03.05. Amplifiye Edilmiş Ürünlerin Saptanması
1)
Ethidium bromidle bantların boyanması: Reaksiyon tüplerinde bulunan amplifikasyon
ürünleri, buradan direkt olarak agarose jel elektroforezise (veya PAGE) tatbik edilir.
Bu ortamda, ürünler molekül ağırlıklarına göre bir separasyona tabi tutulurlar. Bu
işlem sonunda, jel, Ethidium bromide solusyonuna daldırılarak, oluşan bantlar
görülür hale getirilirler. Meydana gelen bantlar, bilinen kontrol bantlarla
karşılaştırılarak bir değerlendirme yapılır. Çok basit ve aynı zamanda kolay
olmasına karşın bu tekniğin bazı dezavantajları bulunmaktadır. Bunlardan biri,
boyama tekniğinin sekans spesitesi zayıftır. Çünkü, istenmeyen veya ilgisi olmayan
DNAlar da amplifiye olabileceğinden bunlar bant analizleri ile belirlenememektedirler.
Her ne kadar, kontrol setler kullanılsa bile yine de böyle sorunlar ortaya
çıkmaktadır. 2)
Southern blot analizi: Amplifiye olmuş ürünler, aynen yukarıdaki teknikte olduğu
gibi, agarose jel elektroforezis (veya PAGE) tabi tutularak molekül ağırlıklarına
göre bir separasyona tabi tutulurlar. Bu aşamadan sonra, agarose jelden katı ortama
(nitroselüloz filtre veya naylona) transfer edilirler (elektro transfer). Bu katı ortam
üzerinde denatüre ve fikre edildikten sonra, işaretli (32P,
biotin, vs.) spesifik problarla hibridizasyona tabi tutulur ve sonuçlar otoradyografi
veya biotin kullanılmış ise renk indeksine göre değerlendirilirler. Film üzerinde
siyah lekelerin (bantlar) bulunması hedef DNAnın amplifiye olduğunu ortaya koyar. Southern
blotting tekniğinin sensitivitesi ve spesifitesi daha yüksektir. Ancak, bu teknoloji de
zaman alıcı ve fazla iş gerektirir. 3)
Solüsyon hibridizasyon tekniği: Daha az olarak başvurulan bu teknikte, amplifiye
edilmiş DNA ürünleri, işaretli problar uygun NaCl yoğunluğuna sahip bir
hibridizasyon solüsyonu içinde bir araya getirilirler. Karışım 95°Cde denatüre
edilerek, DNA iplikçikleri birbirlerinden ayrılırlar. Solüsyon, 50-60°Cye kadar
ılıklaştırılarak spesifik probların sekanslara bağlanması sağlanır. Bu
karışım, poliakrilamid jel elektroforezis (PAGE) tabi tutularak separe edilir. Jel
içerisinde DNA x DNA hibrid molekülleri büyük olduğundan ve yavaş harekete sahip
olacaklarından, başlangıçta yer alırken, küçük moleküller (birleşmemiş problar,
tek iplikçik DNA, vs.) daha hızlı hareket ederek karşı uçta lokalize olurlar. Bundan
sonraki işlemler aynen Southern blottingde olduğu gibi yürütülür ve
değerlendirilir. 4)
Diğer teknikler: Amplifiye ürünleri (amplikon) belirlemeye, diğerlerinin
dezavantajlarını ortadan kaldırmaya yönelik, bazı teknikler de geliştirilmiş ve
denenmiştir. a)
Spesifik problarla hibridize olmuş DNA moleküllerinde, polimeraz enziminin 5'®3'
yönündeki ekzonukleaz aktivitesi, hibridize olmuş probları ayrıştırarak
5'-uçlarında izotop bulunan prob DNAsının boyutlarında küçülmeler oluşturur ve
bunlar da otoradiografı ile ortaya konulurlar. b)
Hibridizasyon proteksiyon testi de aynı amaç için denenmiştir. Bunda, ayrıca, dijital
okuma sistemleri de bulunmakta ve süre çok kısalmaktadır. Amplifiye
ürünleri saptamada, son yıllarda, nonizotopik probların kullanılması yönünde bir
eğilim bulunmaktadır. Biotin veya digoxigeninle işaretlenmiş probları hazırlamak
daha kolay ve daha uzun süre de kullanma olanağı sağlamaktadır. 03.06. PZRda Oluşan Hatalar PZRın
çok yaygın kullanılmasına karşın, reaksiyon sırasında oluşan bazı hatalar
negatif veya pozitif yanlış değerlendirmelere neden olabilmektedir. Bunların minimal
düzeye indirilmesi araştırıcıların ve laboratuvarda çalışan teknik elemanın esas
görevleri arasında olmalıdır. Ancak, bunların bir kısmı temiz çalışmamaktan
kaynaklanmakta, diğer bir bölümü de çalışanların bilgisi dışında
oluşmaktadır. Bu hataların neler olabileceğini iyi bilen teknik kadro, böyle olumsuz
durumları en az düzeye indirebilir. Laboratuvarda
kullanılan bir çok bileşikler PZRda amplifikasyonu önlemekte veya olumsuz yönde
gelişmesine yol açmaktadır. Bunlar arasında deterjanlar, chelating ajanlar (EDTA),
proteinazlar, kanser kemoterapötik ajanları, RNA ve EDTA düzeyinin yüksek olması,
Heparin, Urasil, fenol kalıntısının bulunması, PZRnin duyarlılığına olumsuz
etkileyen faktörlerin belli başlıları arasındadır. Bunlar, reaksiyon sırasında,
DNA veya RNA ile bağlanabilir veya bazlar arasına girerek sonuca olumsuz yönde
etkileyebilirler. Her
ne kadar PZRda ısıya dayanıklı enzimler kullanılmakta ise de, bunların
etkinliklerinin, yüksek ısıdaki yarı ömürlerinin çok iyi saptanması ve ondan sonra
kullanılmaları şarttır. PZRın dışında ki, 3SR, TAS vs gibi metotlarda
genellikle, termolabil enzimlerden yararlanıldığından bunları kullanmadan önce
gözden geçirilmesinde büyük yarar bulunmaktadır. PZRda
en fazla görülen hataların başında non spesifik DNAların (non target DNAlar)
amplifiye olması ve sonuca etkilemesidir. Böyle amplifiye olmuş moleküllerin
laboratuvarlarda birikmesi, örnek materyallere, pipetlere, solüsyonlara, kimyasallara,
pipet uçlarına, vs. bulaşması istenmeyen olguların meydana gelmesine neden olur.
Kontaminasyon problemini minimal düzeye indirebilmek ve bu düzeyde tutabilmek için
fiziksel, kimyasal ve enzimatik kontrollere ve özel önlemlere gereksinim vardır.
Şöyle ki, reagentler bir defa kullanılmalı, teknisyenler kontamine olmamış
eldivenler takmalı, PZR ve diğer işlemler için (amplifikasyon, örneklerin
hazırlanması, amplifiye ürünlerin saptanması, elektroforezis, vs.) ayrı ayrı
odaların bulunması, odalar arası çeşitli materyallerin ve solüsyon nakillerinin çok
sınırlandırılması veya hiç yapılmaması, gibi önlemler, nonspesifik
amplifikasyonları çok azaltır. Hedef
olmayan DNAların ampflikasyonunda, iyi seçilmemiş bazlara sahip probların
hazırlanmasının ve kullanılmasının da rolü büyük olmaktadır. Son
yıllarda amplifiye edilen ürünlerin sterilizasyonuna yönelik bazı teknikler
geliştirilmiş ve başarı ile kullanıldığı açıklanmıştır. Bunlar arasında,
dUTP (deoksi urasil trifosfat) ve UDG (urasil DNA glikosilaz) gibi kodlarla belirtilen
yöntemler bulunmaktadır. Bunlardan ayrı olarak da, bazı araştırıcılar negatif
kontrol kullanmayı tavsiye etmektedirler. Şöyle ki, reaksiyon sonunda negatif kontrol,
pozitif çıkarsa, bütün test ekarte edilir. 03.07. PZRın Başlıca Kullanım Alanları PZRın
hekimlikte bir çok kullanım alanı bulunmakta ve kontrollü çalışmalarda güvenilir,
çabuk, spesifik ve sensitif olması nedeniyle de tercih edilmektedir. 1)
Mikrobiyolojik çalışmalarda PZR: Rutin klinik muayenelerde hastalık ajanlarının
izolasyon ve identifikasyonları oldukça zaman almakta ve bazen de herhangi bir etken
ayrılamamaktadır. Serolojik yoklamalar da, şüpheli veya negatif sonuçlar verdiği
gibi yanlış negatif ve pozitif reaksiyonlar da elde edilebilmektedir. Bunun gibi
olgularda PZR büyük kolaylıklar sağlamaktadır. Her ne kadar PZR direkt teşhis
yöntemi olmamakla beraber, amplifikasyondan sonra işaretli probların kullanılması
veya elektroforezisden sonra oluşan kanıtların boyanarak (ethidium bromidle)
görüntülenmesi, tanıyı kolay hale getirmektedir. PZRn başlıca
kullanıldığı durumlar aşağıda kısaca belirtilmiştir. a)
Kültürü yapılması, izolasyonu ve identifikasyonu çok zor veya yapılamayan
mikroorganizmaların teşhisinde, b)
Toksin oluşturan ajanların, saptanması güç olan toksinlerin ortaya konulmasında, c)
Antimikrobial ilaçlara karşı dirençli olan bakterilerin belirlenmesinde, d)
Mikroorganizmalar içinde alt tiplerin saptanmasında, e)
Gıdalarda, sularda ve yiyeceklerde bulunan mikroorganizmaların tanısında, f)
Diğer mikrobiyolojik araştırmalarda (moleküler immunoloji ve epidemiyoloji,
parazitoloji, bakteriyoloji, viroloji, vs.) PZRdan büyük yararlar sağlanmaktadır. 2)
Adli tıp: DNA fingerprintleri cinayetlerin aydınlatılmasında büyük yardımlar
sağlamaktadır. Babalık tayini ve HLA (histokompatibilite antijenleri) testleri PZR ile
çok kolaylaşmış bulunmaktadır. Cinayet olgularında çok az bir kan, çok az saç
veya sperma test için yeterli olabilmektedir. Böyle olgularda, PZR güvenilir ve çabuk
sonuçlar vermektedir. 3)
Genetik bozuklukların belirlenmesinde: Canlılarda genetik karakter gösteren
bozuklukların belirlenmesinde de aynı etkinlikte kullanılmaktadır. 04. Polimeraz Zincir Reaksiyonunun (PZR) Modifikasyonları Yukarıda
açıklanan ve çok yararlanılan konvansiyonel polimeraz zincir reaksiyonunun bir çok
modifikasyonları yapılmıştır. Bunlardan önemli bazılarının çok kısa olarak
çalışma mekanizmaları aşağıda bildirilmiştir. 1)
İnvers (tersine dönmüş) polimeraz zincir reaksiyonu
2)
Asimetrik polimeraz zincir reaksiyonu 3)
Homopolimerli polimeraz zincir reaksiyonu 4)
İn situ polimeraz zincir reaksiyonu 5)
Hot start polimeraz zincir reaksiyonu 6)
Multipleks polimeraz zincir reaksiyonu 7)
Kantitatif polimeraz zincir reaksiyonu 8)
Nested polimeraz zincir reaksiyonu 9)
RNAnın amplifikasyonu 04.01. İnvers (tersine dönmüş) Polimeraz Zincir Reaksiyonu Bu
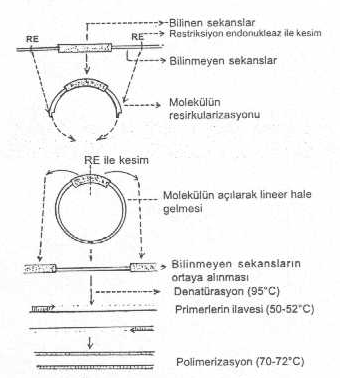
teknik, bilinen sekanslara bitişik olarak bulunan ve fakat bilinmeyen bazlara sahip olan
DNA segmentlerini amplifiye etmede kullanılır. Bilinmeyen sekanslar, tersine çevrilerek
içe alındığı için bu adla tanımlanmaktadır.
1)
Bilinen sekansın iki ucunda bulunan ve baz sıraları bilinmeyen segmentler belli bir
uzaklıktan restriksiyon endonukleaz ile kesilir ve iki tarafta yapışkan uçlar meydana
getirilir. 2)
Bu kesim sonucunda molekül lineer bir forma gelir. 3)
İki yapışkan uç birleştirilerek molekül sirküler şekle dönüştürülür. 4)
Ortada bulunan ve bilinen sekanslara sahip olan DNA segmenti, ortasından başka bir
restriksiyon endonukleaz ile bölünerek molekül tekrar lineer bir forma getirilir. Bu
molekülün iki ucunda bilinen sekanslar bulunmaktadır. 5)
Bu iki uçta bulunan bilinen sekanslara komplementer olan iki ayrı primer hazırlanarak
reaksiyon ortamına katılır. Ayrıca, Taq polimeraz ve polimerizasyon için gerekli olan
4 tür dNTP (dATP, dGTP, dCTP, dTTP) de ilave edilir. 6)
Geri kalan işlem konvansiyonel PZRdaki prosedüre uyularak devam ettirilir. Böylece,
bilinmeyen sekanslara cDNA sentezlenmiş ve bunların baz sıraları da belirlenmiş olur. 04.02. Asimetrik Polimeraz Zincir Reaksiyonu Hedef
DNAnın sadece bir iplikçiğinin amplifikasyonuna yönelik ve farklı oranda (1:50)
primerler kullanılarak yapılan bir polimeraz zincir reaksiyonudur. Asimetrik PZR iki
aşamada gerçekleştirilir. Reaksiyonda az sayıda olan primerler kullanıldıktan sonra,
çok sayıda olan diğer primerler tek iplikçik DNA zincirinin sentezini başlatır ve
çoğaltır.
04.03. Homopolimerli Polimeraz Zincir Reaksiyonu
04.04. İn Situ Polimeraz Zincir Reaksiyonu Bu
tekniğin esasını, morfolojik olarak sağlam hücre ve dokuların DNAsının
amplifikasyonu oluşturur. Bu yöntem, daha ziyade, parafinlenmiş veya arşiv dokuları
için geliştirilmiştir. Bir lâm üzerinde tespit edilmiş ve morfolojik olarak sağlam
hücre veya doku örnekleri hedef DNA (veya mRNA) kaynağı olarak kullanılır. Lâm
üzerine, proteaz solüsyonu ilave edilerek dokulardaki proteinler giderilir ve %0.5
Nonidet P40la da permeabilitesi artırılır. Sonra üzerine amplifikasyonda gerekli
olan komponentler (primerler, 4 tür dNTP, MgCl, ve diğer solüsyonlar) konur ve üzerine
bir lâmel kapatıldıktan sonra kenarları yapışkan bir madde (veya tırnak cilası)
ile sabitleştirilir. Bu aşamadan sonra, lâm alüminyum bir kaba konarak Thermal cyclere
yerleştirilir. Ortama 60°Cde Taq polimeraz ve mineral yağ ilave edilerek lâmel
hemen kaldırılır. Sonraki işlemler, konvansiyonel PZR da olduğu gibidir. Amplifiye
olmuş ürünlerin spesifik olup olmadıklarını saptamada nonradioaklif maddelerle
(biotin, digoxigenin, vs.) işaretli problardan yararlanılır. 04.05. Hot Start Polimeraz Zincir Reaksiyonu Konvansiyonel
PZR yöntemlerinde kullanılan komponentler (hedef DNA, primerler, Taq polimeraz, MgCl2,
dNTP, bufferler, vs.) oda ısısında ve birlikte tüplere konarak aynı anda reaksiyona
sokulurlar. Ancak, bu tarzdaki uygulamada, primerler, reaksiyon başlamadan önce oda
sıcaklığında Taq polimerazın etkisi altında, hedef DNA dışındaki bazı
nonspesifik sekansları da amplifiye etmekte ve böylece yanlış pozitif reaksiyonlara
yol açmaktadır. Bazı durumlarda da primer oligomerizasyonu, primer kaybı, nonspesifik
amplifikasyonlar, vs. meydana gelebilmektedir. Bu olumsuz durumlara mâni olmak için
geliştirilen Hot Start PZRda reaksiyona giren maddelerin bir kısmı (primerler, dNTP,
MgCl2, buffer) oda sıcaklığında tüplere konulmakta, sonra bunların
üzerine buharlaşma ile madde kaybını önlemek için mineral yağ (manuel sistemde)
veya balmumu tableti (otomatik sistemde) eklenmektedir. Geri kalan komponentler (Taq
polimeraz, hedef DNA, buffer) de optimal ısı olan 60-80°C arasında reaksiyon tüpüne
katılırlar. Bundan sonraki aşamalar konvansiyonel sistemdeki gibidir. 04.06. Multipleks Polimeraz Zincir Reaksiyonu Bu
teknik, aynı amplifikasyon reaksiyonunda, farklı hedef DNA sekanslarına yönelik
hazırlanan spesifik multiple primer çiftlerinin kullanılması ile gerçekleştirilir.
Değişik hedef sekanslarının koamplifıkasyonu bir çok amaç için kullanılma
olanağı bulunmaktadır. Şöyle ki, a)
DNA sekanslarının büyük bir bölümü, bunlarda bulunması muhtemel alterasyonlar
yönünden incelenebilirler. b)
Hedef DNAnın farklı segmentleri araştırılabilir, c)
Sekansların amplifiye olabilirliğinin internal kontrolleri yapılabilir d)
Bir numunede bulunan değişik ajanlara ait DNAlar aynı tüpte aynı anda amplifiye
edilebilirler. Bu
test, S. aureus ve C. difficile de denenmiştir. 04.07. Kantitatif Polimeraz Zincir Reaksiyonu Konvansiyonel
PZR, genellikle, kalitatif bir karakter taşır. Diğer bir ifade ile amplifikasyon var
veya yok sorusuna cevap verebilmektedir. Halbuki, son yıllarda geliştirilen yeni PZR
teknikleri ile amplifiye olan hedef DNAnın miktarı hakkında da bir bilgi verebilecek
düzeye ulaşılmıştır. Bu yöntem, reaksiyona başlangıçta konulan hedef DNA
miktarı ile, PZR sonunda saptanan ürünün düzeyi arasındaki lineer korelasyonun
bulunup-bulunmadığını ortaya koymaktadır. 04.08. Nested Polimeraz Zincir Reaksiyonu İki
aşamalı olan bu testte, birinci periyodda, amplifikasyon tek primer çifti ile 15-30 kez
tekrarlanır. Oluşan ve sayısal olarak artan ürünler, yeni bir reaksiyon tüpüne
transfer edilerek burada, internal sekanslara spesifik sekonder primer çiftleri
kullanılarak ikinci bir amplifikasyona tabi tutulur. Bu ikinci defa da 15-30 kez
tekrarlanır ve oluşan ürünler jel elektroforezle ortaya konulurlar. Bu yöntemin avantajları yanı sıra dezavantajları da (özellikle, transfer sırasında meydana gelen kontaminasyonlar, vs.) bulunmaktadır. Bu nedenle iki tüp yerine, tek tüp kullanmak suretiyle kontaminasyon riski minimal düzeye indirilmiştir. Bu tek tüp sisteminde, özellikle, iki tür reaksiyon ısısı kullanılmaktadır (düşük ve yüksek ısı). |
||||||