|
Klonlamada Kullanılan Başlıca Vektörler Prof. Dr. Mustafa Arda
Ankara Üniversitesi
Veteriner Fakültesi 01. Genel Bilgiler 01.
Genel Bilgiler Mikroorganizmalar
arasında gen klonlamasında bir çok aracı moleküllerden (vektör) yararlanılmaktadır. Bunların amaca
yönelik ve bilinçli olarak seçilmesi ve kullanılması gereklidir. Özellikle,
restriksiyon haritalarının, baz sıralarının, gen fonksiyonlarının, hücre içi
replikasyon mekanizmalarının, spesifik markerlerinin, vs. diğer özelliklerinin çok
iyi bilinmesi ve tanınması klonlamanın başarısı için ilk adımı oluşturmaktadır. Gen klonlamasında
başlıca 4 temel vektörden yararlanılmaktadır. Bunlar da, 1)
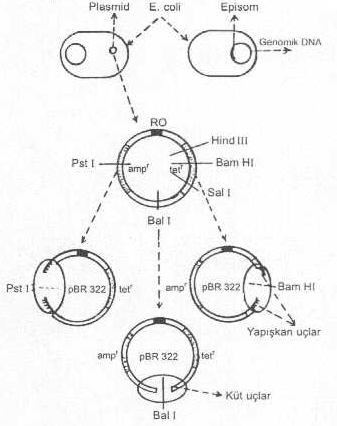
Plasmid vektörler, 02. Plasmid
Vektörler Bazı prokaryotik
(bakteriler) ve ökaryotik organizmalarda (maya, flamentöz mantar, mavi algler, vs.),
hücrenin büyük kromozomundan ayrı olarak sitoplasma içinde ya serbest olarak (plasmid) veya hücre
kromozomu ile birleşmiş halde (episom), DNA
karakterinde ekstrakromozomal genetik elementler bulunmaktadır. Doğal olarak bulunabilen
bu tür plasmidlere, E. coli, P.
aeruginosa, S. aureus, B. subtilis. B. anthracis, C. perfringens, C. tetani, C. botulinum,
vs. sıkça rastlanılmakta ve bunların bazıları da virulensle çok ilişkili
bulunmaktadırlar. Mayalardan, S. cerevisiae de de böyle plasmidlere (2 µ DNA plasmidi) tesadüf edilmiştir. Doğal olarak bulunan bu plasmidlerden gen
aktarımında pek fazla yararlanılamamakta, bunların yerine in vitro koşullarda ve
amaca göre hazırlanan suni plasmidler
tercih edilmektedirler. Plasmidler, çok
sayıda, kolay ve ucuz elde edilmeleri, çift iplikcikli, sarmal ve sirküler bir yapıya
sahip olmaları, yapılarında seleksiyonda önemli fonksiyonu olan bazı spesifik
markerlerin (ampr, telr, kanr, lac+, vs.) bulunması, belli uzunlukta yabancı genleri
kabul etmeleri, infeksiyöz olmamaları, restriksiyon endonukleaz için bazılarında bir
tek kesim yerinin bulunması, replikasyon orijinine sahip olmaları ve buna bağlı olarak
ta hücre içinde bağımsız olarak replikasyon özelliği taşıması, vs. gibi hususlar
plasmidlerin fazla oranda vektör olarak kullanılmalarının başlıca nedenleri
arasında gelmektedir. Plasmidlerin
DNAlarında bulunan böyle bölgeler (tet, ampr,
kanr, strr,
lac+, vs.), bunların hücre içinde
replikasyonları için pek önemli değildirler. İşte, rekombinant plasmid
(kimerik plasmid, hibrid plasmid) elde etmede, bu sekanslar içine aktarılması
istenen gen (hedef gen,
hedef DNA) yerleştirilir ve hangi genin içine transfer edilmişse o gen inaktif hale gelir ve
diğer gen(ler) aktivitelerini korurlar.
Rekombinant DNA
teknolojisinde kullanılan suni plasmid vektörler
yapılarına ve fonksiyonlarına göre başlıca 4 temel grupta toplanabilirler. Bunlar
da; 02.01. Normal Plasmid Vektörler Bu tür plasmid
vektörlerde sadece rezistenslik veya
diğer genler (ampr, tetr, lac+,
vs.) ile replikasyon orijinleri vardır. Basit bir restriksiyon haritasına
sahiptirler. Yabancı gen DNA segmenti, rezistenslik genlerinden biri içine aktarılarak
inaktive edilir ve diğer gen, koloni seleksiyonu için, sağlam olarak bırakılır.
Plasmidle birleştirilen gen, sonra, alıcı hücrelere (Örn., E. coli ye) aktarılır. Alıcı hücrede genin
eksprese edilip edilmediği, gen ürününün kontrolü ile yapılır. Ancak, bu tarzda
hazırlanan vektörlerdeki genler alıcı hücre içinde çok zayıf eksprese olurlar veya
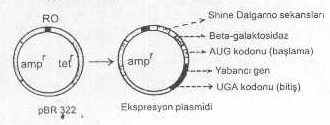
olmayabilirler. Bu amaçla, pBR322 plasmidinden yararlanılabilir. 02.02. Ekspresyon ve Ekskresyon Vektörler Yabancı gen
DNAsının alıcı hücrede (Örn., E. coli de) etkin bir tarzda ekspresyonunu sağlamak
için bakterinin replikasyon mekanizması tarafından kolayca tanınabilen ve alıcı
bakteriye ait kuvvetli bir prokaryotik promotorlardan
(DNAnın üzerinde bulunan ve RNA polimeraz enziminin bağlandığı ve
transkripsiyonun başladığı bölge) biri yabancı gen DNAsının 5'- ucuna
bağlanarak plasmide eklenir ve böyle hazırlanan vektör plasmid, alıcı hücre
tarafından kolayca algılanarak ekspresyon şansı, normal plasmid vektörlere oranla,
çok artmış bir duruma getirilir. En fazla kullanılan promotorlar arasında, tryptophan promotoru, beta galactosidase vs.
sayılabilir. Bu tarzda oluşturulan plasmidlere ekspresyon plasmidleri
adı verilir. Bazı durumlarda da
promotorun ön kısmına, diğer bazı DNA sekansları (Shine-Dalgarno
sekansları) ilave edilerek, transkripsiyonda oluşan mRNA nın ribosomun 30S
alt ünitesine güvenle ve kuvvetle başlanması garanti altına alınır. Böyle
plasmidlere ayrıca AUG başlatma kodonu ile terminasyon sekansları da bağlanabilir. Bu
amaçla UGA tripleti kullanılır.
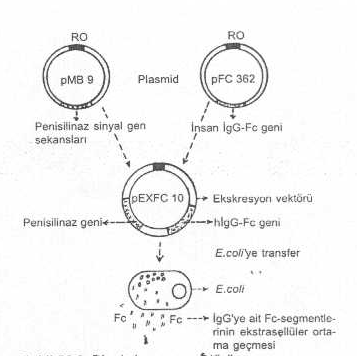
Alıcı bakteri
içinde, ekspresyonunun sağlaması istenen gen ürününün makromolekül olduğu (Örn.,
IgG Fc-porsiyonu, insülin, vs.) durumlarda, sentezlenen substanslar hücreden dışarı
çıkamaz ve içerde kalır. Bunun kısmen de olsa hücre dışına salgılanmasını
sağlayabilmek için ekskresyon
plasmid vektörler geliştirilmiştir. Örn., insan IgGnin Fc-porsiyonunu
kodlayan geni, Bacillus sp. ait beta laktamaz geni ile birlikte bir plasmide
(pEXFC-10) bağlandıktan sonra E. coli
ye transfer edilirse, E. coli içinde
beta laktamaz enzimi sentezlenip dışarı salgılanırken IgGnin Fc-porsiyonu da
dışarı çıkar. Aslında, bu plasmidler de, bir tür ekspresyon plasmidleridir .
Yukarıdaki tarzda
dizaynı yapılarak kullanılan plasmid vektörler (normal veya ekspresyon vektörleri)
sadece bir tür alıcı hücrede veya konakcıda replike olabilir ve taşıdıkları gen
eksprese edilebilir. Bunun dışındaki hücrelerde (ökaryotiklerde) replike olamazlar.
Çünkü, bu son alıcı hücrelere ait RO'ya ve promotora sahip değildirler. Eğer,
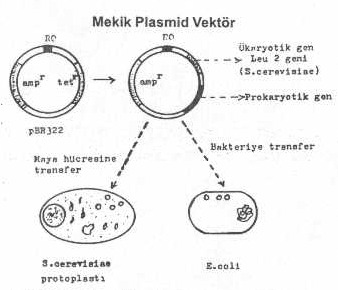
prokaryotik promotor taşıyan ekspresyon vektörlerine, ökaryotiklere ait bir promotor
da ilave edilirse, bu tarzda hazırlanan vektör hem prokaryotik ve hem de ökaryotik
mikroorganizmalarda replike olabilir. Örn., prokaryotik promotor içeren plasmide, Saccharomyces
cerevisiae ye ait bir promotor olan
Leu-2 (veya tryptophan, histidin, arginin, vs.) de
ilave edilirse, bu plasmid hem bakteride ve hem de maya hücresinde replike olabilir ve
taşıdığı genin ekspresyonunu sağlayabilir (bifonksiyonel plasmidler).
Gen konstraktlarının
az miktarda hazırlandığı veya gen DNAsının az elde edildiği durumlarda, birinci
alıcı hücrede (Örn. E. coli de)
genin ekspresyonu değil de, genin fazlaca üretimi ve gen sayısının artırılması (amplifikasyon) amaçlanabilir. O zaman,
kendisine yabancı gen taşıyan plasmid aktarılmış olan E. coli, içinde
chloramphenicol (170 mg/ml) bulunan ortamda
üretilirse, bakteride çok sayıda (binlerce) spesifik gen taşıyan plasmid gelişebilir
ve bakteri DNAsının % 30-40'ına ulaşabilir. Ayrıca, genin ampflikasyonu için,
spesifik primerler kullanılarak PCRdan da yararlanılabilir. Gen sayısı
artırıldıktan sonra bakteri lize edilerek içinden plasmid ekstre edilir ve bundan da
hedef gen DNAsı çıkarılır. Eğer istenirse, bu gen DNAsı bu mikroorganizmaya
ait vektör plasmide eklenerek tekrar E. coli ye veya maya hücresine ait bir plasmide
(pRITI2363) bağlanarak S. cerevisiae protoplastına transfekte edilebilir. Örn., Hepatitis B virusuna karşı aşı hazırlamada
bu yöntemden yararlanılmıştır. Ekspresyon vektörleri
yardımı ile E. coli içinde bir çok genin klonlaması ve ekspresyonu
sağlanmıştır. Bunlar arasında, insan
insülin hormonu, insan büyüme hormonu, rat büyüme hormonu, sığır büyüme hormonu,
interferon, difteri toksini, ürokinaz enzimi, pilus antijeni, ovalbumin,HGPRT enzimi,
Hepatitis B, vs. vardır. 02.04. Plasmid Tabanlı Ökaryotik Vektörler Bu tür vektörler,
genellikle, ökaryotik hücrelere (memeli, kanatlı hücreleri) yabancı genlerin
aktarılması ve ekspresyonu için geliştirilmiş vektörlerdir. Bu nedenle de, yabancı
genle birleştirilmiş olan plasmide, kuvvetli viral promotor ve regulatör (terminasyon)
sekanslar da ilave edilerek COS hücrelerine transfekte edilirler. Eğer istenirse, önce,
yabancı gen taşıyan plasmid bir bakteriye aktarılarak genin fazlaca üretimi
sağlanabilir. Ökaryotik hücreye transfekte edilen vektördeki genin ekspresyonu
sağlanır. 03. Faj Vektörler Gen transferlerinde,
aracı diğer bir molekül olarak, çeşitli faj DNAlarından da yararlanılmıştır.
Bakteriyofajlar, genel anlamda, bakterilerde üreyen ve lizis oluşturan bakteri viruslarıdır.
Bir çok bakterinin kendilerine özgü fajları vardır ve bunlar, bakterilerin
identifikasyonlarına ve teşhislerine de büyük katkıda bulunurlar. Fajların bazıları,
kendi konakçılarında lizis (virulent fajlar)
meydana getirmelerine karşın bir kısmı da bakteri içinde bulunduğu halde, herhangi
bir zararlı etkide bulunmazlar (Örn. E. coli ye ait lambda fajı, C. diphtheriae
ait beta fajı, vs.). Bu tür fajlar bakterinin genomu ile birleşir, onun bir devamı
haline gelir, onunla birlikte eş zamanlı olarak replike olur ve her hücre bölünmesi
sırasında da, bakteri DNAsı ile birlikte kardeş hücreye aktarılır (profaj). Lambda fajı ve beta fajı birer profajdırlar. Vektör olarak,
genellikle, E. coli ye ait
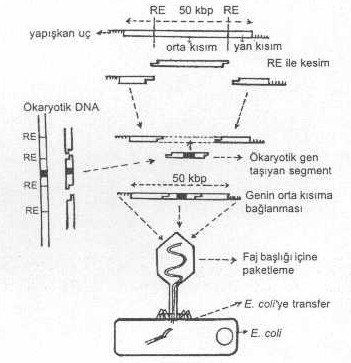
fajlardan (Lambda, M13. vs.) ve ayrıca fajmid ve kosmidlerden de yararlanılır. 03.01. Lambda Fajı Gen transferi amacı
ile lambda fajı (çift iplikcikli, lineer, yaklaşık 50 kbp uzunlukta, 31 x 106 dalton molekül ağırlığında) başarı ile
denenmiştir. Faj DNAsının her iki ucunda (5'-uçlarında) 12 bazlık ve birbirinin
komplementeri olan nukleotidler lokalize olmuşlardır (yapışkan uçlar, cohesive
ends, cos). Faj DNAsı E.
coli ye girdikten sonra başlıca
2 replikasyon formu gösterir. 1) Litik form: Faj başlığı içinde lineer tarzda
bulunan faj DNAsı, bakteriye girdikten sonra yapışkan uçlar birbirleriyle
birleşerek, molekül sirkülarize olur. Bu form, bakteri içinde, bidireksiyonal olarak
hızla çoğalır ve faj DNAsı artar. Bir süre sonra, bu dairesel replikatif
formlardan (RF) bazıları, rolling circle replikasyon fazına geçerek birbirlerine
yapışkan uçlarla (coslarla) birleşmiş lineer uzun faj DNAsı meydana gelir. Bu
dönemde fonksiyonu olan özel enzimler (paketleme
enzimleri, protein A) lineer faj DNAsını, cos bölgelerinden, 50 kblık
mesafelerden olmak üzere, keserek oluşan segmentleri faj başlığı içine paketler.
Böylece olgun fajlar meydana gelir ve bakteri parçalanarak fajlar dışarı çıkarlar. 2) Lizojenik form: Bakteri içinde bulunan fajlardan
bazıları, E. coli kromozomunda galactose
ile biotin genleri arasındaki
özel bölgeye homolog rekombinasyonla
girerek integre olur ve faj, bakteri DNAsının bir devamı haline gelir (profaj). Bu faj bakteriyi normal koşullar
altında lize etmez ve eş zamanlı olarak replike olur ve kardeş hücreye aktarılır. Lambda fajının orta
bölgesi, bakteri içinde litik bir üreme için gerekli değildir. Bu bölge, başka bir
gen ile yer değiştirebilir. Yani, fajın ortası çıkarılarak buraya yabancı gen
aktarılabilir. Böyle bir değişme de fajda zararlı bir etki yaratmaz. Ancak,
yanlardaki sekanslar önemli olup litik üreme için gerekli bilgileri taşırlar.
Ayrıca, her biri 15-20 kb uzunlukta olan yanlarda, faj başlığını ve kuyruğunu
kodlayan sekanslar da bulunur. Fajın orta bölgesi
restriksiyon endonukleaz enzimi ile iki yerinden kesilerek orta segment çıkarılır,
buraya yaklaşık aynı boyda, yabancı gen taşıyan segment (aynı RE ile kesilmiş)
fajın orta kısmına yerleştirilir. Sonra, paketleme enzimi yardımı ile faj
başlığı içine paketlenir ve buradan da başka bir E. coli ye transfer edilir. Böylece, yabancı bir
gen faj vektör yardımı ile bakteriye aktarılmış olur.
Yabancı geni, fajın
orta kısmına birleştirmede dikkat edilecek önemli nokta paketleme enziminin tanıma
sınırlarıdır. Bu enzim, ancak 50 kb uzunlukta bulunan cos-bölgelerini tanıyarak
buralardan keser. Eğer, yabancı gen çok küçük ise, iki cos-bölgesi arası
daralacağından, paketleme enziminin tanıma sınırlarının altında kalacaktır veya
yabancı gen çok büyükse, aktarılan genle birlikte yanların toplam uzunluğu 50
kbın çok üstünde olacağından paketleme enziminin tanıma sınırlarının yine
dışında olacak ve böylece, her iki gen DNAsı fajla birleşse bile faj başlığı
içine paketlenemeyecektir. Diğer önemli noktada, gerek faj ve gerekse yabancı gen
DNAsı aynı RE ile kesilmesi ve birbirlerinin komplementeri olan yapışkan uçların
meydana getirilmesidir. Yukarıda bahsedilen problemleri gidermek için özel fajlar (lambda gt-beta, lambda gt-10, lambda gt-11, charon faj
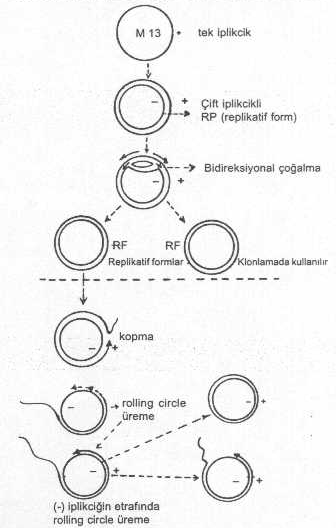
serisi, vs.) hazırlanmıştır. 03.02. M13 Fajı Tek iplikcikli
flamentöz fajlardan olan E. coli M13
fajı, lambda fajı kadar olmasa bile, yabancı genlerin aktarılmasında
denenmiştir. M13 fajı, E. coli nin
seks pilusuna yapışır ve yaklaşık 6.8 kb uzunluktadır. M13 fajı bakteri içine
girince, kendine ait olan tek iplikçik DNA, bakterinin replikasyon mekanizması
tarafından buna ikinci bir cDNA sentezlenerek, çift iplikcikli hale dönüştürülür.
Böylece sirküler ve çift iplikcikli replikatif
formlar (RF) meydana gelir. Bu
RF'ler rolling circle tarzında bir replikasyon gösterirler. M13 fajının bir E. coli içinde yaklaşık 100-200 kopyası
bulunabilir. Belli bir üreme döneminden sonra, tek iplikcikli faj DNAsı oluşmaya
başlar ve bunlar faj başlığı içine girerler.
M13 fajının çift
iplikcikli replikatif formları gen aktarımlarında vektör olarak yararlanılır. Bu
formlar, bakteriden ekstre edilerek çıkarılır ve üzerinde gerekli manipulasyonlar
yapılır. RFlere yaklaşık 300-400 bazlık bir yabancı geni aktarmak mümkündür.
RFler bir restriksiyon endonukleaz ile kesildikten sonra, E. coli ye ait beta galactosidase (Z) geni ve bunun
da amino terminal bölgesine yakın kısmına polilinker bağlamak mümkündür. Bu
işlem, fajda herhangi bir fonksiyonel bozukluk meydana getirmediği gibi, E. coli ye transfekte edildiğinde, bu gen eksprese
olabilmektedir. Eğer kendisinde aktif beta galactosidase geni bulunan E. coli,
bileşiminde, isopropyl-trigalactosidose (IPTG)
ve bir kromojenik madde olan X gal bulunan
katı ortamda üretilirse, faj bakteriyi eriterek mavi renkli plaklar meydana getirir.
Eğer, beta galactosidase geninin bir bölgesinde bulunan polilinker içine bir yabancı
gen aktarılırsa, o zaman, bu gen inaktive olur ve bakteri içinde eksprese olamaz ve
renksiz plaklar meydana gelir. Bu denemelerde kullanılan E. coli, beta
galactosidase yönünden negatif bir karakter taşımaktadır. Birinci denemede,
bakteriye aktarılan beta galactosidase aktif olduğu için sentezlenen enzim ortamdaki
substratlarla etkileşerek mavi renk meydana getirmesine karşın, ikinci denemede gen
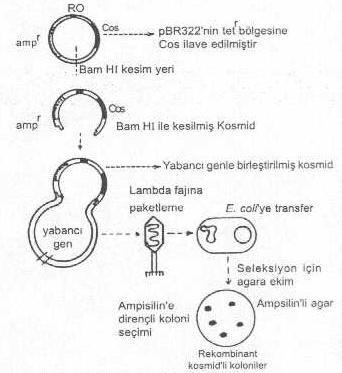
inaktif olduğu ve bakteride de bu gen bulunmadığından renksiz plaklar oluşmaktadır. 03.03. Kosmid (cosmid) Vektörler Kosmid vektörler, bir
bakteriye ait ve replikasyon orijin bölgesine sahip plasmidle, buna birleştirilmiş
lambda fajı yapışkan ucundan (cos, cohesive ends) oluşturulmuşlardır. Bazı
kosmidlerde tek bir cos bulunmasına karşın, iki bölgeli veya mekik kosmidler meydana getirmek de olanak
dahilindedir. 1) Tek cos bölgeli kosmid vektörler: Bu vektörler
için lambda fajının E. coli de
rolling circle tarzındaki replikasyon fazından elde edilen lineer faj DNAsındaki cos
bölgeleri RElerle kesilerek çıkarılır. Bunlar, pBR322 plasmidinin tetr geni içine integre edilir ve böylece tek bir cos
bölgesine sahip kosmid vektör elde edilir. Böyle bir kosmid yaklaşık 6 kb uzunlukta
olup, yapısında plasmide ait replikasyon orijini (RO), ampr geni ve cos bölgesi bulunur. Bu tarzda
hazırlanan kosmid yaklaşık 35-40 kb uzunlukta yabancı bir geni kabul edebilir ve
aktarabilir. Kosmide yabancı gen integre edebilmek için, önce kosmid Bam HI ile muamele
edilir ve molekül açılarak lineer hale getirilir. Alkalin fosfataz ile etkilendirilerek
vektör-vektör ligasyon (sirkularizasyon) önlenir. Aynı anda da yabancı gen DNAsı,
aynı RE ile muamele edilerek gen DNA segmenti çıkarılır. Bu parçanın 35-40 kb kadar
olması, paketleme enziminin tanıması için gereklidir. Gen DNAsının iki ucundaki
yapışkan uçlarla, açılan bölgedeki yapışkan uçlar birleştirilerek vektör
hazırlanır. Paketleme enzimi de 45-50 kb uzaklıktan tanıyarak keser ve faj başlığı
içine paketlenir. Bir kosmidde iki tane ampr
geni veya iki tane orijin bölgesi bulunamaz.
2) Çift cos bölgeli kosmid vektörler: Tek cos
bölgeli vektörlere bir alternatif olarak iki cos bölgesine ve iki markere (ampr, kanr)
sahip vektörler de hazırlanmış ve kullanılmıştır. Kosmidler iki RE ile aynı anda
kesildiğinde iki lineer parça elde edilir ve her birinde bir cos bölgesi ve bir marker
bulunur. Yabancı gen DNAsı, iki cos bölgesi arasına integre edilir. diğer
işlemler aynen tek cos bölgeli kosmidde olduğu gibi yürütülür. 3) Mekik (shuttle) kosmid vektörler: Bu tarzda
dizaynı yapılan vektörlerde cos bölgeleri ve markerleri yanı sıra prokaryotik ve
ökaryotik hücrelere ait genetik DNA sekansları da bulunur. Bunlar da 35-40 kblık
yabancı DNAyı kabul edebilir ve transferini sağlayabilir. 4) Fajmidler: Plasmid ve fajların bazı
sekanslarından oluşan fajmidler de bazı
genlerin transferinde denenmiştir. Örn., immunglobulin geninin E. coli de ekspresyonunda pHEN10 fajmidinden yararlanılmıştır. 04. Viral
Vektörler Viral vektörler, daha
ziyade, prokaryotik ve/veya ökaryotik genlerin hücrelere (memeli, kanatlı, vs.)
aktarılması ve genlerin ekspresyonları için, çok uygundurlar. Ökaryotik hücrelerde
üredikleri için de böyle vektörlere, ökaryotik viral vektörler
adı da verilmektedir. Viral infeksiyonlara karşı etkin aşıların hazırlanmasında da
son yıllarda, viral vektörler oldukça önem kazanmıştır. Virusların vektör
olarak kullanılabilmesi için, bunların moleküler yapılarının, hücre ve konakcı
spektrumlarının, hücrelerde replikasyon özelliklerinin, paketlenmelerinin, hücrelerde
oluşturdukları bozuklukların ve diğer karakterlerinin çok iyi bilinmesi
gerekmektedir. Ayrıca, bazı kriterlere de uymaları aranan vasıflar arasındadır.
Şöyle ki, konakcı ve hücre spektrumu geniş olmalı, büyük bir DNA segmentini kabul
edebilmeli ve kendi replikasyonunu önlememeli, infeksiyöz ve onkojenik olmamalı ve
birden fazla farklı genleri alabilmelidir. Genetik materyallerin
ökaryotik hücrelere etkin bir tarzda transferlerini ve ekspresyonlarını sağlamak
için bazı DNA ve RNA viruslarından rekombinant ökaryotik
viral vektör olarak yararlanılmıştır. Bunlardan başlıcaları aşağıda
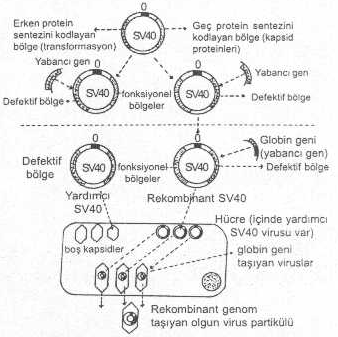
özet olarak belirtilmiştir. 04.01. DNA Virus Vektörleri 1) Simian virus 40(SV40) vektörleri: DNA
karakterinde çift iplikcikli, sarmal ve sirküler bir genoma sahip olan SV40, yaklaşık
5.2 kbp uzunluktadır. Virus, maymun hücrelerinde CPE meydana getirerek litik bir üreme
tarzına sahip olmasına karşın, rodent hücrelerinde transformasyonlar yapabilir. Viral
genom başlıca 3 bölgeden oluşmaktadır (replikasyon orijini, erken
protein gen bölgesi ve geç protein gen bölgesi). Erken gen bölgesi, virusun
replikasyonunda ve transformasyon oluşturmasında rolü olan büyük (T) ve küçük (t) ile ifade edilen proteinlerin ve
geç gen bölgesi de kapsid proteinlerini sentezlemede ve paketlemede fonksiyona
sahiptirler. SV40dan bir çok
tarzda rekombinant viral vektör hazırlanmış ve çeşitli genlerin transferinde de
kullanılmıştır. Hazırlanan başlıca SV40 vektörleri kısaca şöyledir. a) Virusun erken gen
bölgesine yabancı bir gen (Örn., beta globin,
Influenza virusu HA geni, vs.)
birleştirilirse, bu bölge inaktive olur ve SV40 defektif hale gelir. Böyle vektör, hücrelere transfekte
edildiğinde, hücre içinde T-proteini (antijeni) sentezlenemediğinden, virus replike
olamaz ve transformasyonlar da yapamaz. Bu vektörün replikasyonu için, hücre içinde
sağlam (veya erken gen bölgesi sağlam) SV40 virusu (yardımcı virus, helper
virus) bulunan COS hücrelerine (maymun hücresi) aktarılması gereklidir.
Defektif viral vektör bu hücrelerde, kendisinin replikasyonu için lüzumlu olan
T-antijenini bularak replike olmaya başlar ve yabancı gen ile birlikte kapsid içine
paketlenerek olgun viruslar meydana gelir. b) Eğer, yabancı gen,
SV4Oın geç gen bölgesine aktarılırsa bu bölge inaktive olur. Virus, normal
hücrelere transfekte edildiğinde, kapsid sentezi ve paketleme olamayacağından olgun
virus teşekkül edemez. Bu olumsuzluğu gidermek için, defektif virus, COS hücrelerine
aktarılır. Bu hücrelerin içinde bulunan normal SV40 virusu tarafından sentezlenen,
fakat kendisinin kodlayamadığı kapsid içine girer ve olgun virus meydana gelir.
Böylece yabancı gen olgun viruslara ve bunlar aracılığı ile de, hücrelere
aktarılarak ekspresyonları sağlanmış olur.
c) Eğer, SV40ın
erken gen bölgesi yabancı bir genle inaktive edildikten sonra, içinde, her iki gen
bölgesi aktif ve fakat replikasyon orijin bölgesi çıkarılmış mutant bir SV40la
infekte edilmiş hücrelere aktarılırsa (bu mutant virus hücrelerde replike
olamamasına karşın, hücrelerin kromozomu ile birleşebilir ve T-antijeninin sentezini
uyarır) defektif virus hücrede T-proteinlerini bulacağından replike olur ve kapsid
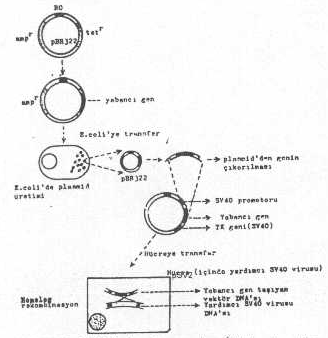
içine paketlenebilir. d) SV40dan plasmid tabanlı vektörler
de hazırlanmış ve bir çok genin ekspresyonunda da kullanılmıştır. Yabancı gen,
önce bir plasmide (pBR322, vs.) aktarılır (plasmidin tetr geni içine integre edilerek bu gen inaktive
edilir). Plasmid böylece replikasyon orijin bölgesi ampr geni ve yabancı gen sekanslarından oluşmuş olur.
Eğer istenirse, bu aşamada, plasmid bir bakteriye (E. coli ye) aktarılarak genin fazla
üretimi sağlanabilir. Bakteri lize edildikten sonra, hem plasmid ve hem de plasmiddeki
yabancı gen çıkartılır ve viral vektöre bağlıdır. Bu plasmide, SV40ın
promotoru ile regulatör gen sekansları da eklenir. Ancak, yabancı gen, SV4Oa ait
sekanslar arasında bulunmalıdır. Böylece plasmid tabanlı rekombinant
viral vektör (Örn. pSV2) elde edilmiş olur. Bu vektör, içinde SV40 virusu
bulunan yardımcı hücrelere transfekte edildiğinde, plasmidde bulunan SV40 ait
sekanslarla, hücre içindeki virusa ait özdeş sekanslar arasında homolog rekombinasyonla
birleşme meydana gelir ve yabancı gen, hücredeki viral genoma aktarılır. Bununla
birlikte kapsid içine paketlenir .
e) Yabancı gen (beta
globin, vs.) içeren plasmide (pBR322), SV4Oın sadece replikasyon orijin bölgesi
sekanslarına bağlandıktan sonra içinde T-antijeni sentezlenen COS hücrelerine
aktarılırsa, vektörün çok sayıda kopyası ile birlikte globin mRNAsı da meydana
gelir ve gen eksprese olur. f) Yabancı gen (HSV-Tk
geni) taşıyan pBR322ye SV40ın sadece replikasyon orijin bölgesi de
bağlandıktan sonra elde edilen bu rekombinant vektör, Tk- fare hücrelerine aktarılırsa, bu hücreleri Tk+ hale getirirler. Vektör bu hücrelerin
kromozomları ile birleşir ancak replike olamaz. Eğer, böyle hücreler, içinde
T-antijeni sentezlenen hücrelerle füsyona tabi tutulursa, oluşan hibrid hücrelerde
üretilen T-antijenleri Tk+ hücrelerin
çekirdeklerine girer, kromozomla birleşir ve vektörün bidireksiyonal replikasyonuna
yol açar. Böylece, hibrid hücre içinde çok sayıda Tk+ geni taşıyan sirküler vektör elde edilir (SV40
orijini+HSV-Tk+amp+). Bu plasmid tabanlı
vektör E. coli de de replike
olabilir ve HSV-Tk geni pozitif koloniler elde edilebilir (mekik vektör). Yabancı gen,
prokaryotiklere ait bir gen (guanosin fosforibosil transferase enzimi, gpt) ise ve bu gen,
içinde SV40ın sadece replikasyon orijin bölgesi promotoru bulunan bir plasmide
(pBR322) aktarılırsa oluşan vektör (pSV2gpt) mekik vektör olarak kullanılabilir. SV40dan hazırlanan
çeşitli vektörlerle, beta-globin, HBsAg, Adv EI A proteini, İnfluenzae virusu-Ha ve NS
genleri, vs. hücrelere aktarılarak ekspresyonları sağlanmıştır. 2) Vaccinia virus vektörleri:
Vektör olarak hazırlanan ve fazlaca kullanılan viruslar arasında Vacciniada
bulunmaktadır. Virus DNA karakterinde bir genoma sahip olup çift iplikcikli, lineer ve
yaklaşık 187 kbp uzunluğundadır. Viral genom 150-200 gen ürünü kodlayabilecek bir
kapasitededir. Geniş bir hayvan türünde infeksiyon oluşturabilir ve çeşitli
hücrelerde de üreyebilir. Hücre içinde, infeksiyondan 12-15 saat sonra 15000 den fazla
virus kopyasına rastlanabilir. Vaccinia virusuna eklenecek sekansların üst sınırı
henüz saptanamamış olmasına karşın 25 kbp uzunlukta yabancı bir geni kabul
edebilmektedir. Vaccinia virusunda bir çok, markerler (Tk, çeşitli temperatür
sensitivite ve konakcı genişliğini belirleyen sekanslar, vs.) bulunmaktadır. Vaccinia virusundan
değişik şekilde vektörler hazırlanmış ve kullanılmıştır. a) Vaccinia virus
genomunda bulunan Timidin kinase (Tk) geni, virusun hücre içi replikasyonu için pek
gerekli değildir ve infektiviteye de bir katkısı bulunmamaktadır. Dolayısıyla, bu
gen içine yabancı DNA sekansları integre edilebilir ve vektör olarak kullanılabilir.
Ancak, aktarılan genin ekspresyonu zayıf olur. b) Vaccinia virusundan,
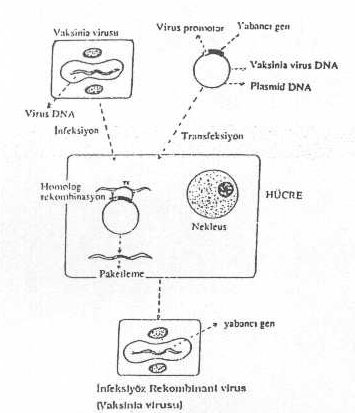
aynen SV40 da olduğu gibi, plasmid tabanlı rekombinant vektörler hazırlanabilir.
Burada da yardımcı virus ve hücrelerden yararlanılır.
Vaccinia virusu
vektörleri bir çok genin (HSV-Tk, Influenza virus-HA, Hepatitis B yüzey antijeni,
HSV-glikoprotein D, kuduz virusu glikoproteini, VS-G proteini, IB-spike geni, vs.)
aktarılmasında vektör olarak kullanılmıştır. Rekombinant vaccinia
virus vektörleri, gen transferleri yanı sıra, biyolojik aktif moleküller üretmek,
rekombinant aşılar hazırlamak, yabancı genleri hücre içinde izlemek, gen replasman
sağaltım çalışmaları yapmak, vs. amaçlar için de kullanılmaktadır. Vaccinia genomuna
birden fazla yabancı gen integre edilebilmekte ve bunların hücre içi ekspresyonları
sonunda, gen ürünleri sentezlenebilmektedir. Örn., vaccinia virusuna,
IB+Marek+NDVlarının kapsidlerini kodlayan genler promotorlar ile birlikte integre
edilebilir ve böylece polivalan aşılar hazırlanabilir. 3) Polyoma virus vektörleri: Papova grubunda
bulunan polyoma virusu, 5.2 kbp uzunlukta, çift iplikcikli, süpersarmal bir DNAya
sahiptir. Fare hücrelerinde litik üreme tarzı gösterir. Bu özelliği ile SV4Oa
benzerliği vardır. Bundan da, infeksiyöz olan ve olmayan vektörler hazırlanmış ve
polyoma yardımcı hücrelerinde (MOP)
üretilmişlerdir. Polyoma virus vektörlerine, fare İmmunglobulin A zinciri geni
aktarılarak elde edilen vektör fare myeloma hücrelerine transfekte edilmiş ve
infeksiyondan 48-72 saat sonra, hücrelerde IgA sentezlenebildiği saptanmıştır. 4) Adenovirus vektörleri: İnsanlara ait Adv-2 ve
-5 virusları bazı genlerin transferlerinde kullanılmıştır. Viruslarda DNA
karakterindeki genomlar lineer olup yaklaşık 35 kb uzunluktadır. Viral DNAnın iki
ucunda tersine
tekrarlanan terminal sekanslar bulunmaktadır. Adenoviruslardan, yardımcı
viruslara bağımlı olmayan (helper indipendent)
vektörler gen aktarımlarında ve genlerin ekspresyonlarında denenmişlerdir.
Adenoviruslarında, non-essential
coding olan E3 bölgesi içine yabancı gen katılarak E3 promotorunun kontrolü
altında, veya E4 bölgesi ile tersine tekrarlanan terminal sekansların (kodlama yapmayan bölge) arasında Adv-major
promotorunun kontrolü altında, yabancı genler integre edilerek hazırlanan vektörler,
hücrelere aktarılarak ekspresyonları sağlanmıştır. Adv-5e, HSV-l
glikoprotein B geni bağlanarak hücrelerde ekspresyonu yapılmış ve fareleri virusun
letal dozuna karşı koruduğu belirlenmiştir. Adv-2 ve -5ten infeksiyöz olan ve
olmayan vektörler hazırlanmış ve HBsAg, vs. genlerin klonlanmasında ve ekspresyonunda
kullanılmıştır. 5) Herpes virus vektörleri: Bu grupla bulunan
virusların DNA karakterindeki genomu lineer olup yaklaşık 150 kbp uzunluğundadır.
Konakcı hücrelerinde, genellikle, latent infeksiyonlar oluşturur. İnsanlara ait olan HSV1 ve Varicella
zoster viruslar (VZV) nöronlarda
latent infeksiyon ve Epstein-Barr virusu (EBV) da hem beta -ve hem de tükürük bezi
hücrelerinde benzer tarzda üreme karakteri gösterirler. Kanatlıların Marek Hastalığı virusu
(MDV) ve hindilerin
herpes virusları (THV) da bu grupta olup kanatlıları aşılamalarda aşı virusu
olarak denenmişlerdir. HSV-1 virusundan
plasmid tabanlı ve HBsAg yabancı geni taşıyan rekombinant vektör hazırlanarak,
içinde yardımcı HSV üreyen hücrelere transfekte edilmiş ve homolog rekombinasyonla
yabancı gen, hücre içindeki virus genomuna aktarılarak genin ekspresyonu
sağlanabilmiştir. Viruslarda Timidin kinaz (Tk) geni, virusun hücre içinde
replikasyonunda gerekli olmadığı (nonessential) için yabancı genler, genellikle, Tk
geni içine integre edilmektedir. Bunun dışında, HSVlerin % 20 kadar bölgesinin
nonessential olduğu ve virusun infektivitesinde rolünün olmadığı da
belirtilmektedir. Herpes viruslarının çift iplikcikli büyük bir genoma sahip
olmaları, bunların, Vaccinia virusları gibi birden fazla geni taşıyabilecekleri
(farklı serotiplere ait veya farklı cinslere ait etkenlerin genleri) açıklanmaktadır.
Herpes virusları yaklaşık 10 kb uzunluğunda yabancı geni tolere edebilmektedir. Kanatlı aşılarının
elde edilmesinde de, gerek MDV ve özellikle, THV vektör olarak kullanılabileceği
belirtilmiştir. 6) Bovine papilloma virusu tip-1 (BPV-1) vektörleri:
Bu virus, in vivo olarak keratinositlerde ve in vitro olarak ta konakçı hücrelerinde
üreyebilmektedir. BPV-1, DNA karakterinde çift iplikcikli sirküler bir genoma sahip
olup yaklaşık 8 kbp uzunluktadır. Dar bir hücre spektrumu göstermesine karşın,
bazı fare cell-linelerinde malignansi oluşturan virus, bir çok genin (insan
interferon B1, HBsAg, SV40ın erken gen bölgesi, rat insülin geni. vs.) fare
hücrelerine (C127, 1 D 13, rat FR 3T3, vs.) aktarılmasında etkin bir vektör olarak
kullanılmıştır. BPV-1 den değişik
uzunlukta (3.10, 3.7, 4.4 kb. vs.) plasmid tabanlı rekombinant vektörler (pBPV-1 8-2,
pBPV-1 9-1, pBPV-1 69T vs.) hazırlanarak, içinde helper virus bulunan hücrelere
transfekte edilmiş ve ekspresyonu
sağlanmıştır. Plasmid tabanlı
BPV-1den mekik vektörler de hazırlanmıştır. 7) Epstein Barr virus vektörleri: Bu virus da
klonlamada vektör olarak denenmiştir. 04.02. RNA Virus Vektörleri RNA karakterinde genoma
sahip viruslardan bazıları, özellikle, retroviruslar
rekombinant vektör olarak fazlaca kullanılmaktadırlar. Hücrelerin kromozomları ile
birleşme özelliği taşıyan retrovirusların replikasyon tarzları, diğer
viruslarınkinden farklıdır. Lineer tek iplikcikli (iki moleküllü) 5-7 kb uzunlukla
bir genetik materyale sahip olan virus, hücre içine girince sitoplasmada, revers transkriptase enzimi yardımı ile,
genomik RNAya tek iplikçik cDNA (copy DNA, komplementer DNA) sentezlenir. Sonra, bu
cDNAya da polimeraz 1 enzimi ile ikinci bir cDNA sentezlenerek çift iplikcikli
DNAya dönüştürülür (pro virus). Bu pro
virus, hücre çekirdeği içine girerek kromozomla birleşir ve transkripte olur. Oluşan
viral RNA sitoplasmaya geçer ve burada sentezlenen kapsid içine paketlenir. Olgun virus
hücrelerden tomurcuklanarak dışarı çıkarlar. Vektör olarak
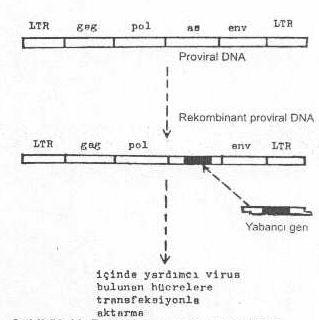
yararlanılan çift iplikcikli sirküler pro virusun her iki ucunda long terminal repeat (LTR)
olarak tanımlanan ve yüzlerce baz çiftinden oluşmuş tekrarlanan uzun sekanslar
bulunmaktadır. Bu uçlar transkripsiyonu başlatmada ve bitirmede etkin bir regulatör
sinyal mekanizması görevine sahiptirler
(promotor). Provirus, LTRlerden sonra, zarf proteini (env), RNAya
bağımlı DNA polimeraz (reverse transcryptase, pol) ve grup antijenleri (gag)
gibi bölgelere de sahiptir. Yabancı gen, provirusun gag, env, vs, gen bölgelerinden
biri içine integre edilir ve hücrelere (NIH 3T3, vs.) transfekte edilir (helper virus
içeren yardımcı hücreler). Vektörün hücre içinde replikasyonu ve genin ekspresyonu
sağlanır.
Retroviruslarından,
ayrıca, plasmid tabanlı vektörler hazırlanmış ve gen aktarımında
kullanılmıştır. Retroviruslardan olan kanatlıların avian leukosis virusu (ALV)
ve avian reticuloendotheliosis virus (REV) viruslarından özellikle ikincisi,
onkojenik olmaması nedeniyle vektör hazırlanmasında tercih edilmektedir. Baculovirus
Vektörleri İnsektlere ait olan Baculoviruslar da bazı genlerin
(kanatlıların Newcastle Hastalığı virusuna ait bazı genler) aktarılmasında
vektör olarak denenmişlerdir 05.
Bakteriyel Vektörler Yabancı genleri
klonlamada, her ne kadar virus ve plasmidler kadar yoğun bir kullanım alanı
bulamamasına karşın, bakteriyel vektörler son yıllarda bazı genleri bakteri
genomlarına klonlamada başarı ile denenmiştir. Bunlar arasında başlıca, S. typhimurium
un
okzotrofik bir mutantı olan AroA SL 3261 suşu
(üremesi için p-aminobenzoata gereksinimi
vardır), K88 fimbria, termolabil-B toksini ve 65 kDluk mikobakteri (M. tuberculosis) antijenik
determinantlarını klonlamada kullanılmıştır. Bu tarzda hazırlanan rekombinant bakteriyel
vektörler, farelere verildiğinde hem S. typhimurium a ve hem de taşıdığı gen ürünlerine
karşı humoral ve sellüler bir yanıtın meydana geldiği açıklanmıştır. S. typhi
nin
genetik modifiye mutantı olan S. typhi Ty2la suşu (galactose epimerase negatif), S.
sonnei antijenik determinantlarının klonlanmasında kullanılmıştır. E. coli
K12 suşu da V. cholerae
antijeni için aynı amaçlarla denenmiştir. Bacille Calmette Guerin (BCG) suşuna da yabancı genler aktarılarak bunların ekspresyonunun sağlanması olanakları araştırılmakta ve ayrıca BCGnin adjuvant etkisinden de yararlar sağlanmaktadır. |
||||||||||||||||||||||