|
Virusların
Üremesi (Viral
Replikasyon)
Prof. Dr. Mustafa Arda
Ankara Üniversitesi
Veteriner Fakültesi
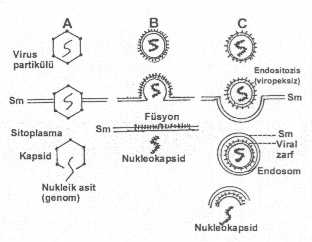
02. Hücre Membranına
Bağlanma (Adsorbsiyon) 03. Hücreye Giriş (Penetrasyon,
Endositozis, İnternalizasyon) 04. Kapsidin veya
Zarfın Çıkarılması
05.02. DNA Viruslarında Transkripsiyon
05.03. RNA Viruslarında Transkripsiyon 06. Nukleik Asitlerin Replikasyonları
(Genom Replikasyonu)
06.01. DNA Viruslarında Replikasyon
06.02. RNA Viruslarında Replikasyon 07. Viral Komponentlerin Sentezleri Ve Birleştirilmesi
(Asamble)
07.01. İkosahedral (kübik simetri) Viruslarda
07.02. Helikal Simetrili Viruslarda
07.03. Kompleks Yapılı Viruslarda 08. Virusların Olgunlaşması (Maturasyon) 09. Virusların Hücrelerden Çıkışları
(Serbest Kalma)
09.01. Hücrelerin Ölmesi (Sitolizis) 01.
Genel Bilgiler Virusların hücre içindeki
multiplikasyon tarzlarını incelemede bakteriyofajların modelliğinden fazlaca
yararlanılmıştır. Fajların bu özelliklerini saptamada kullanılan
teknikler, hayvan viruslarına da adapte edilerek bunların canlı sistemlerde
(hücre, embriyolu yumurtalar, deneme hayvanları) replikasyon aşamaları
(virusların hücrelere bağlanılışından olgunlaşıp çıkıncaya kadar geçirdiği
evreler) ayrıntılı olarak belirlenmiştir. Ancak, yine de tam olarak
saptanamayan ve kesin olarak ortaya konamayan bazı noktalar hala bulunmaktadır.
Elektron mikroskopların da virusların bu karakterlerini incelemede çok büyük
faydaları olmuştur. Virusların duyarlı hücrelerde
replikasyon aşamaları, genellikle, 7 kısımda incelenmektedir. Her ne kadar,
basamakların tümü direkt olarak ve gerçek anlamda nukleik asit sentezi ile
bağlantılı değilse de, bu basamakların birlikte öğrenilmesinin konunun bütünlüğünün
korunmasına ve daha kolay kavranılmasına yardımcı olacaktır. Bu aşamalar
da, 1) Hücre
membranına bağlanma (adsorbsiyon) 2) Hücreye
giriş (penetrasyon, endositozis, internalizasyon) 3) Kapsidin
ve/veya zarfın çıkarılması 4) Viral
ekspresyon a)
Transkripsiyon b)
Translasyon 5) Nukleik
asit sentezi (genom replikasyonu) 6) Viral
komponentlerinin sentezi ve montajı (asamble) 7)
Virusların olgunlaşması ve hücrelerden çıkışları 02. Hücre Membranına
Bağlanma (Adsorbsiyon) Virusların hücrelere girebilmesi ve
bunun sonucunda da infeksiyon (litik veya nonlitik) oluşturabilmesi için, önce
duyarlı hücrelere bağlanmaları gerekir. Zarfsız viruslarda kapsidin
spesifik protein yapısı veya zarflı viruslarda, zarfın yüzeyinde bulunan
protein ve glikoprotein karakterindeki özel moleküllerin (ligand, viral bağlanma proteinleri), duyarlı hücrelerin yüzeylerinde
bulunan ve değişik kimyasal (protein, glikoprotein, oligosakkarid,
lipoprotein, vs) yapıya sahip spesifik
reseptörlere sıkıca bağlanması giriş için ilk ve önemli sinyali
verir. Glikoproteinler, karbonhidratlardan daha fazla bağlanma etkinliğine
sahiptirler ve daha fazla spesifiktirler. Aksi halde virionun ve hücre yüzeyinin
negatif yüklü olmaları bağlanmayı (ligand-reseptör
afinitesi) zorlaştırır. Bu nedenle virion ile hücre arasında
kuvvetli bir kimyasal ilişkinin bulunması gereklidir. Ancak, şunu da hatırdan
çıkarmamak gerekir ki, konakçının genetik duyarlılığı yanı sıra,
kanlarında spesifik nötralizan
antikorların da bulunmaması çok önemlidir. Ayrıca, konakçının immun yetmezlik hastalığına sahip olması veya immunsupresif
ilaç kullanması infeksiyonu kolaylaştırır. Yüzeylerinde spesifik reseptörler taşımayan
hücreler, genellikle, viruslarla bağlanamazlar. Belli spesifik bir virusa
duyarsız olan veya yüzeylerinde spesifik reseptör taşımayan hayvanlar,
embriyolarına, spesifik reseptör geni verilerek transgenik hale getirilirse, bunların hücrelerinin yüzeylerinde
spesifik reseptörler oluşur ve virus adsorbe olur ve içeri girebilir. Ancak,
yüzeylerinde spesifik reseptör saptanamamasına karşın virusa duyarlı hücrelerin
olabilmesi de mümkündür. Bu durum, viral genetik materyallerinin
transfeksiyonla hücrelere girebileceği veya virusun primer
reseptörlerden ayrı olarak, sekonder
veya alternatif reseptörler de
kullanabileceği anlaşılmıştır. Diğer bir ifade ile viruslar, bir veya
birden fazla reseptörden yararlanmaktadırlar. Bazı Viruslarda ligand ve reseptörleri
Fener,1993 EGF : Epidermal growth factor, EGFR : Epidermal growth factor reseptörü CEA : Carcinoembriyonic antigen ACR : Acetyl cholinesterase reseptörü B-AR : Beta adrenergic reseptör ICAM-1 : Intracelluler adhesion molekülü-1 FIDV : Feline immundeficiency virus PPEV :Porcine polioencephalomyelitis virusu Bazı viruslar için, hücre yüzeyindeki
reseptörlerin sayısının 100000'den fazla olabileceği belirtilmiştir. Örn,
adenoviruslar için böyle bir durum söz konusudur. Bir konakçının bütün hücreleri
aynı virusa karşı tam bir duyarlılık göstermeyebilir veya bazı hücreler
daha fazla hassas olabilirler. Örn, insanlarda poliovirusuna karşı
nazofarinks, barsak, spinal kord (anterior kısım) hücreleri spesifik reseptörleri
taşır ve virus bunlara bağlanır.
Kuduz virusu için de nöronlar (asetil
kolin reseptörleri) bağlanma yerlerini oluştururlar. Viruslar
ile reseptörler arasındaki ligand-reseptör ilişkisinin, hem virusun duyarlı
hücreyi bulmada ve hem de doku
tropizmini ve konakcı
spesifitesini oluşturmada önemli fonksiyonu bulunmaktadır. Buna bağlı
olarak, insanlarda infeksiyon oluşturan bazı viruslar (polio, kızamık,
Kabakulak, HIV, vs) hayvanlarda ve hayvanlarda hastalık oluşturan bazı
viruslar da (At vebası, sığır vebası, Marek, Gumboro, vs) insanlarda
infeksiyon oluşturmazlar. Buna karşın kuduz virusu, Newcastle virusu ve bazı
viruslar da zoonotik bir özellik gösterirler. Bu son durum, bir virusa karşı
çeşitli hayvan türleri hücreleri yüzeyinde ortak reseptörlerin bulunmasından
veya bir virus türü için, primer reseptörlerden ayrı oyarak sekonder veya
alternatif reseptörlerin bulunmasından kaynaklanmaktadır. Örn, HIV için
birden fazla türde reseptörün varlığı gibi. HIV'in esas reseptörü,
lenfositlerin yüzeyindeki CD4 molekülüdür. Ayrıca nöronal hücre yüzeyinde
de sekonder reseptörü vardır. Bazen de, bir reseptör birbirine yakın veya
ayrı viruslar için ortak bağlanma yerlerini oluşturabilirler. Veya birbirine
yakın viruslar (insan ve fare coronavirusları) farklı reseptörleri tercih
edebilirler. Ayrı familyalarda bulunan viruslar aynı reseptörü
kullanabilirler. Şöyle ki, Coxsackie B3 virusu (RNA, enterovirus) ile
adenovirus-2 (DNA) aynı reseptörü paylaşılabilir. HIV (RNA, retrovirus) ile
herpesvirus 7 (DNA), her ikisi de CD4'ü kullanabilirler. Bazen de viruslar,
ikincil reseptörlere adapte olabilir ve bunlardan yararlanabilirler (swine
vesicüler hastalığı virusu, SVDV). Eğer hücre yüzeyindeki spesifik
reseptörler enzimatik olarak giderilirse virusun bağlanamaması nedeniyle
infeksiyon oluşmaz. Ancak, Coxsackie A9 (CAV-9, insan enterovirus) bir integrin
olan vibronektin aVB3'ü
reseptör olarak tercih eder. Bu integrin enzimatik olarak giderildiğinde
virusun infeksiyonuna mani olunamamaktadır. Çünkü, virus bu reseptör yerine
alternatif bir reseptörden yararlanmaktadır. Tablo: Bazı viruslar için plasma membran molekülleri (reseptörler)
Wimmer.1994;Levy, 1994
Yukarıda açıklanan nedenlerle
viruslar birden fazla ve farklı yapıda reseptör kullanabilmektedirler. Zarflı viruslar için hücre yüzeyindeki
reseptör sayısının, zarfsız olanlardan, daha fazla olduğu belirtilmiştir.
Bu durum da, zarflı virusların daha kolay hücrelere girebileceğini ve
infeksiyon oluşturabileceğini de göstermektedir. Viruslar,
hücre yüzeyindeki reseptörlerle, ilk başlangıçta zayıf kuvvetlerle (hidrojen
bağları, iyonik atraksiyon,
van der Waals kuvvetleri) bağlanır.
Ayrınca, virusun tek bir reseptöre bağlanması da adhezyonu reversible duruma
getirir. Zamanla, bir kaç reseptörle ilişki kurması, bağlantıyı güçlendirir
ve irreversible hale koyar. Bu nedenle kros bağlantılar adhezyonu
kuvvetlendirirler. Bu fenomene, aynı zamanda, ortamın pH'sı ve tuz yoğunluğunun
da etkisi bulunmaktadır. Ayrıca, reseptörlerde ve/veya ligandlarda bulunan
amino ve karboksil gruplarının da rolleri vardır. Çünkü, bu grupların
tahribi veya inaktive edilmesi bağlanma üzerine olumsuz etkilediği açıklanmıştır.
İnsan rhinovirus tip-2 ile poliovirus tip-2'nin hücrelere bağlanması Con
A (lektin, concanavalin A) tarafından önlenebilmektedir. Con A, reseptörlerdeki
alfa-D-mannoz molekülleri ile ilişki kurarak bunların aktivitesini önler ve
bağlanmayı inhibe eder. Virusların
yüzeylerinde bulunan bağlanma molekülleri (ligand), hücrelerdeki birkaç tür
reseptörle bağlantı kurabilecek bir karakter taşımaktadırlar. Zarflı
viruslarda zarfta bulunan peplomerler
(hemaglutinin, neuraminidase,
F-proteini) ile adenoviruslarındaki fiberler
reseptörlere bağlanmada etkin rol oynarlar. Paramyxoviruslarında virionun yüzeyindeki
F-proteini, hücre yüzeyinde enzimatik olarak aktive olduktan sonra,
sitoplasmik membranla birleşir (füsyon).
Böylece serbest kalan nukleokapsid sitoplasmaya transfer edilir,. Reseptörler,
sadece virusları bağlamada etkinlik göstermez, aynı zamanda virusun
sitoplasmaya geçişine ve hücreye çeşitli uyarımları vermede de etkili
olmaktadır. Ancak, bazı reseptörlerin de, virusu sadece adsorbe ettiği buna
karşın hücre içine girmede etkisinin olmadığı da açıklanmıştır. Örn,
HIV'in rodent hücrelerindeki CD4'e bağlandığı fakat internalizasyona yardımcı
olmadığı belirtilmiştir. Viruslar,
yukarıda açıklanan ligand-reseptör bağlantısı nedeniyle hücrelere
adsorbsiyonu (direkt mekanizmalar)
yanı sıra, indirekt mekanizmalar
yardımı ile de hücrelere bağlanabilir ve internalize olabilir. Bu son
durumda, kanda bulunan spesifik antikorların (özellikle, İgG ve İgM) ve
komplementin rolleri fazla olmaktadır. Hücrelere bağlanmada reseptör olarak
FcR ve CR (komplement reseptörü) fonksiyoneldir. Viruslara, Fab bölgeleriyle
bağlanan antikorların serbest kalan Fc porsiyonları hücre yüzeyindeki
FcR'leri ile de kolayca bağlanır. Oluşan, virus
+ antikor + FcR veya CR kompleksi, ayrıca, hücre içine sinyal vermede,
virusun internalizasyonunda ve infeksiyonunda (antikora
bağımlı infeksiyon, ABİ) görev alabilir. Bu son durum, antikorların
varlığında, virusların da infeksiyon yapabileceklerini, immun bireylerden
elde edilen hücrelerde viral değişikliklerin oluşabileceğini, virusların hücrelerde
intrasellüler olarak canlı kalabileceklerini ve infeksiyon oluşturabileceği
gibi önemli sorunları da beraber getirmektedir. 03. Hücreye Giriş
(Penetrasyon, Endositozis, İnternalizasyon) Elektron mikroskopik ve diğer, in vivo
ve in vitro çalışmalar, virusların hücrelere girişlerinde oldukça ayrıntılı
bilgiler vermiştir. Virusların hücrelerdeki spesifik reseptörlere sıkıca
bağlanması ve bu fenomenin irreversible olması, hücreye giriş için ilk adımı
oluşturmasına karşın, bu kuvvetli ilişkinin devam etmemesi, virusun serbest
kalmasını önlememesi ve girişe engel olmaması yönlerinden de önemlidir.
Virus, hücre yüzeyine adsorbe olduktan sonra peplomerlerdeki glikoproteinlerde
bazı konformasyonal değişiklikler meydana gelir ve bunlar virusun girmesine
yardımcı olur. Zarflı viruslardaki F-proteinin, sitoplasmik membranla birleşmesi
(füsyon) nukleokapsidin sitoplasmaya geçişini çok kolaylaştırır. Zarfta
bulunan neuraminidase enzimi
(sialidase), reseptör proteinlerdeki sialik
asiti hidrolize ederek virusun serbest kalmasına (elüsyon) ve içeri
girişine yardımcı olur. Endositozis
(viropeksiz) olayı da, hücrelere girişte yardımcı olan bir
fenomendir. Reseptörler, viruslarla bağlanmaları yanı sıra, virusun içeri
girmesine ve iç kısma sinyal vermede
de görev yaparlar. Bu sinyaller, virus sitoplasmaya geçmeden önce, hücre içinde
virus için bir hazırlık yapılmasını da uyarır. Viruslar zarfsız ve zarflı olduklarına
göre başlıca 3
genel mekanizma ile sitoplasmik membranı geçerek sitosola ulaşırlar.
03.01.
Zarfsız Viruslar Adenoviruslar, reoviruslar ve diğer
zarfsız viruslar da nukleokapsidlerinde meydana gelen bazı değişiklikler
aracılığı ile sitoplasmik membranı kolayca geçebilir (kapsid ile birlikte)
sitoplasmaya ulaşır ve burada kapsidleri enzimatik olarak ayrıştırılarak
nukleik asitler serbest kalırlar. 03.02.
Zarflı Viruslar Zarflı viruslar da başlıca iki
tarzda sitoplasmik membranı aşarak hücre içine girerler. 1) Plasma
membranı ile füsyon: Yüzeyinde F-proteini bulunan viruslarda, bu
protein hücre membranı ile kolayca birleşir
ve nukleokapsid serbest kalarak sitoplasmaya ulaşır. Bu olguda,. zarf hücre
membranı ile birlikte dışarıda kalır içeri girmez (paramyxovirusları ve
diğerleri) 2) Endositozis
(viropeksiz): Endositozis, normal hücreler tarafından uygulanan, hücre
yüzeyindeki reseptörlere bağlanmış olan partiküllerin internalizasyon yöntemidir.
Viruslar hücre yüzeyindeki reseptörlere tutunduktan sonra, virusu tümden
saran plasma membranı ile çevrilir ve böylece içeri alınır. Bu olguda,
virionun etrafında zarftan ayrı olarak sitoplasmik membrandan da bir katman
bulunur. Virionun etrafındaki dış muhafaza çıkarıldıktan sonra endosomla
birleşirler (asidik lisozomal vesiküller).
Burada, asidifikasyonun etkisi ile zarftan da sıyrılarak nukleokapsid sitosola
geçer. Togaviruslar, orthomyxoviruslar, rhabdoviruslar ve diğer helikal
simetrili viruslarda bu tarz girişe rastlanmaktadır. Zarflı ikosahedral viruslarda
(flaviviruslar, hepadnaviruslar) bu iki mekanizmadan birisinden yararlanmaktadırlar.
Ya zarf dışarıda kalır kapsid direkt olarak içeri girer veya virus tümden
endositozisle içeri alınır. Sonra muhafazalarından sıyrılarak viral genom
serbest kalır. İndirekt mekanizma: Yukarıda bahsedilen ve virusların
direkt olarak hücrelere genel giriş mekanizmaları yanı sıra indirekt mekanizmaları kullanarak internalizasyonu üzerinde gerek
in vivo ve gerekse in vitro bir çok araştırmalar yapılmış ve yayımlanmıştır.
İndirekt mekanizmada, virus yüzeyindeki moleküller yanı sıra, bivalent
ligandların (antikorlar) ve hücre yüzeyinde bulunan özel reseptörlerin (FcR ve CR) önemleri
bulunmaktadır. Ligandlar arasında İgG (İgG1, İgG3); farelerde İgG2a; İgG
+ komplement; İgM + komplement), komplement, soluble CD4 gibi moleküller yer
almaktadır. Monositler, makrofajlar, polimorfnukleer hücreler, dendritik hücreler
(Langerhans hücreleri), B-, T-, NK hücreleri FcR ve CR yönünden oldukça
zengindirler. İgG için 3 tür FcR (FcRI, FcRII, FcRIII), İgM, İgA ve İgE için
de birer tür reseptör bulunur. FcR'lere aynı zamanda intestinal hücrelerde
de rastlanılmaktadır. Fare makrofajlarında da 3 tür FcR (FcRI, FcRII,
FcRIII) vardır ve bunlar sıra ile İgG2a, igG2b ve İgG3'e bağlanırlar.
Bivalent ligandların hem viruslara ve hem de hücre yüzeyindeki reseptörlere
bağlanması sonucu da oluşan (virus+ligand+reseptör) kompleksinin internalize
olabileceği ve hücreleri infekte edebileceği araştırıcılar tarafından açıklanmıştır.
Antikor olmadan da (non immunolojik
olarak), virus + komplement + faktör B kompleksinin komplementi indirekt
yoldan aktive ederek infeksiyonu restore ettiği HIV-1 ile infekte MT-2 hücrelerinde
yapılan in vitro çalışmalarda ortaya konulmuştur. Yüzeylerinde FcR taşımayan
hücrelerde, C3R'nin var olması durumunda, İgG+komplement+virus kompleksinin
infeksiyonu kolaylaştırabileceği belirtilmiştir. Monoklonal veya poliklonal nötralizan
antikorların, eğer nötralizan antikorlar nötralizasyon sınırının üstündeki
sulandırılmalarda ise, antikora bağımlı infeksiyonu desteklediği belirtilmiştir.
Genellikle, pozitif serumların yoğun konsantrasyonları virusları nötralize
etmelerine karşın yüksek sulandırmalarda virusun üremesini destekleyici
etkiye sahip olabilmektedirler. Özet olarak, indirekt mekanizmaların da
virusun hücreye girişine ve infeksiyonuna yardımcı olabileceği yapılan çalışmalarda
ortaya konulmuştur. Eğer, kanda, antikorlar, nötralizasyon noktasının üzerinde
bulunuyorsa, etkili olabilmekte ve virusun hücreye girişini ve infeksiyon oluşturmasını
desteklemektedir (antikora bağımlı
infeksiyon). 04. Kapsidin veya
Zarfın Çıkarılması Viral genom sitoplasmaya girdikten
sonra hücre içindeki çeşitli enzimlere (DNase, RNase, protease, vs) çok
duyarlı olduğundan, hemen transkripsiyonun ve diğer işlemlerin (translasyon,
replikasyon) başlaması ve bitirilmesi gerekmektedir. Virusların
yapısal karakterlerine göre başlıca dört tür mekanizma ile kapsid ve/veya
zarflardan kurtulma gerçekleştirilmektedir. Bunlar da, 1)
Zarfsız viruslarda (picornavirusları gibi), virion hücre membranına bağlandıktan
sonra, kapsidde konformasyonal değişiklikler meydana gelerek kapsid
proteinlerinden VP2 ve VP4'lerde serbest kalma ve kayıplar meydana gelir. Bu
durum, kapsidin proteazlara daha duyarlı hale gelmesine neden olur. Plasma
membranında oluşan zayıf noktalardan nukleokapsid sitoplasmaya ulaşır ve
burada kapsidden ayrılan genom (nukleik asit) fonksiyonu olan bölgeye gider. 2)
Herpesviruslarında nukleokapsid sitoplasmaya girdikten sonra nükleer membranla
birleşir ve DNA nükleer membrandaki deliklerden içeri girerek replikasyon bölgesine
ulaşır. 3)
Poxviruslarında, nukleik asitin etrafındaki zarflardan ayrılma,
sitoplasmadaki endosomlar (veya vakuoller) içinde gerçekleşir ve DNA serbest
kalarak sitoplasmaya geçer ve replikasyonun bütün aşamaları sitoplasmada
tamamlanır. 4)
Zarflarında F-(füsyon) Proteini bulunan viruslarda (paramyxoviruslar, vs) bu
spesifik protein hücre membranı ile birleşerek membranda kalır ve
nukleokapsid serbest kalarak sitoplasmaya geçer ve buradan replikasyon bölgesine
gelir. Diğer zarflı viruslar (orthomyxovirus, togavirus, vs) ise endositozis
(viropeksis) ile içeri girer, endosomlar içinde toplanır ve burada zarflarından
ayrılan genom serbest kalarak sitoplasmaya geçer. Helikal
nukleokapside sahip viruslarda transkripsiyon, viral RNA henüz zarftan tam ayrılmadan
önce başlar. İkosahedral zarfsız reoviruslarında ise, sadece bazı kapsid
proteinleri çıkartılır ve serbest kalan viral genom bütün fonksiyonları sürdürür.
Hatta, viral genom kapsidden tam ayrılmadığı zaman bile transkripsiyon başlayabilir. 05. Viral Ekspresyon Viral
genomun ekspresyonu başlıca iki önemli aşamada gerçekleşmektedir.
Bunlarda, 1) Nukleik asitlerin
transkripsiyonu ve 2) Translasyonudur.
Ancak, henüz bütün virus familyalarının veya virusların viral
ekspresyonlarının ayrıntılı aşamaları tam belirlenmiş değildir. 05.01.
Transkripsiyon Virusların
ekspresyonlarının ilk ve önemli aşamasını mRNA (mesenger RNA) sentezi oluşturur
(transkripsiyon). Viral genom
tarafından spesifiye edilen mRNA'lar, aynı zamanda, sellüler ribosomlarda
viral proteinlerin sentezini de (translasyon)
programlar. Viral nukleik asitler, virusların strüktürel proteinleri yanı sıra,
nukleik asit replikasyonu, gen ekspresyonu, virusun asamblesi, olgunlaşması ve
hücrelerden çıkışları için gerekli olan özel ve çok spesialize olmuş
proteinlerin ve enzimlerin sentezlerini de yönetir. Diğer bir ifade ile
viruslar, duyarlı hücrelerin sitoplasmalarına girdikten ve etraflarındaki
muhafazalardan (kapsid veya zarf) kurtarıldıktan sonra, konakcı hücrenin bütün olanaklarını, kendi üretimi için programlar
ve kendi lehine çevirirler. İnfeksiyonun başlangıcında ve infekte hücrelerde,
viral mRNA'nın meydana gelmesi, hücre yönetiminin virus tarafından ele geçirildiğini
de ifade eder. Transkripsiyon, genel anlamda, genomda
(DNA viruslarında) kodlar (şifreler) halinde bulunan genetik bilgilerin (informasyonlar)
DNA'ya bağımlı RNA polimeraz enziminin (transkriptaz)
katalitik etkisi ile sentezlenen mRNA'ya yine şifreler halinde aktarılması
olgusudur. Diğer bir ifade ile mRNA genetik şifrelerden oluşur. Bakterilerde genetik materyalin çift
iplikçikli, sirküler ve sarmal DNA olması nedeniyle, transkripsiyonda bu
iplikçiklerin sadece biri (3'¬
5' yönünde olanı) kullanılarak, transkriptaz enziminin RNA polimeraz
enziminin polimerizasyon etkinliği ile bu iplikçikte (DNA) bulunan genetik
bilgiler tek iplikçik mRNA'ya şifreler halinde aktarılır. Bakterilerde kolay
olan bu fenomen, viruslarda ise çok daha komplikedir. Viruslar, genetik materyal olarak DNA
veya RNA'lardan sadece birine sahip olmaları, tek veya çift iplikçikli,
lineer veya sirküler, pozitif veya negatif polariteli, segmentli veya
segmentsiz bulunmaları transkripsiyon mekanizmalarına etkilemekte, bu
durumlara bağlı olarak ta, transkripsiyon için değişik stratejilerin ortaya
çıkmasına yol açmaktadır. Ayrıca, ökaryotik hücrelerde RNA'ya
bağımlı RNA polimeraz enzimi de bulunmamaktadır. Bu nedenle de ssRNA (single
stranded RNA) ve dsRNA (double stranded RNA) virusları transkripsiyonları için
bu enzimlerin kodlarını kendi genomlarında taşımak zorundadırlar. Bunun
yanı sıra, ökaryotik hücreler ilk başlangıçta sentezlenen polisistronik
mRNA'ları daha küçük proteinlere transle edebilecek mekanizmalara da sahip
değildirler. Bu yönleri ile de, sentezlenen polisistronik mRNA'ların
monosistronik hale getirilmesi gerekmektedir. Virus gruplarının özelliklerine göre
değişiklikler gösteren transkripsiyon stratejilerine ait aşağıda çok kısa
ve özlü bilgiler verilmektedir. 05.02.
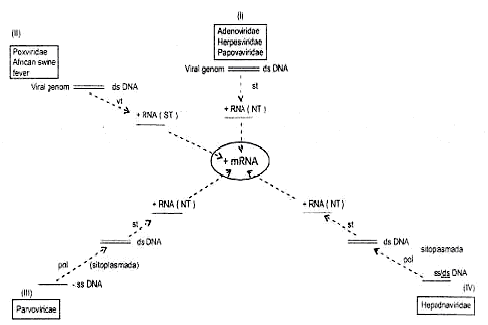
DNA Viruslarında Transkripsiyon Bazı DNA viruslarında, mRNA, hücreye
ait, DNA'ya bağımlı RNA polimeraz enziminin (transkriptaz) katalitik etkisi
ile sentezlenir (transkripsiyon).
Poxviridae viruslarında ise viral transkriptaz enzimi kullanılır. Ancak,
viral DNA'nın transkripsiyonu, nukleik asitte bulunan bütün genlerin aynı
anda ve devamlı olarak ekspresyonunu sağlayacak tarzda proglanmış değildir.
Şöyle ki, genomik DNA'da bulunan bazı genler erken
ve bir kısmı da geç transkripte
edilirler. DNA virusları, RNA viruslarının aksine, sellüler ayrıştırma
mekanizmaları kullanarak, sentezlenen polisistronik RNA'ları monosistronik
mRNA molekülleri haline dönüştürebilme kapasitesine sahiptirler. DNA virus
familyaları arasında, viral veya sellüler transkriptazın kullanma durumuna
ve replikasyon bölgesinin sitoplasma veya nukleus olduklarına göre,
transkripsiyon mekanizmalarında da bazı spesifik değişiklikler meydana
gelmektedir. Transkripsiyon ve replikasyon aşamaları, poxvirusları hariç,
nukleusda gerçekleştirilir.
1) Çift
iplikçikli DNA (dsDNA), sellüler transkriptaz kullananlarda:
Adenovirusları, herpesvirusları ve papovaviruslarında, viral DNA'nın bir
iplikçiği kullanılarak, konakcı hücrelerinin çekirdeklerinde hücreye ait
ve DNA'ya bağımlı RNA polimeraz II enziminin katalitik etkisi ile transkripte
edilir. Polisistronik ve fakat subgenomik (genlerin hepsini değil bir kısmını
taşıyan) özellik gösteren bu transkriptler (+mRNA), enzimatik olarak ayrıştırılarak
monosistronik mRNA'lara dönüştürülür. Bunlar nukleustan sitoplasmaya
transfer edilerek ribosomlar üzerinde translasyona tabi tutulurlar (No.I). 2) Çift
iplikçikli DNA (dsDNA), virion transkriptaz kullananlarda: Sitoplasma da
replike olan viruslarda (poxvirusları, African swine fever virusu), viral
genom, kendi transkripsiyonunu sağlamak için transkriptaz enziminin kodlarını
taşır. Virus sitoplasmaya ulaşınca, muhafazalarında kurtulur ve serbest
kalan genom, önce transkriptaz enziminin sentezini gerçekleştirir. Enzim,
DNA'yı transkripte ederek monosistronik (+) mRNA'ların oluşmasına yol açar
(No. II). 3)
Tek iplikçikli DNA (ssDNA) sellüler transkriptaz kullananlarda:
Parvoviruslarında genomik ssDNA, kalıp olarak kullanılarak, hücreye ait
polimeraz enzimi tarafından çift iplikçikli (dsDNA) haline dönüştürülür.
Bu DNA hücre nukleusuna girerek, burada, hücresel transkriptaz enzimi yardımı
ile polisistronik mRNA sentezlenir. Bu da enzimatik olarak ayrıştırılarak
monosistronik mRNA'lar elde edilir. Buradan sitoplasmaya transfer edilerek
translasyonda kullanılırlar (No III). 4) Tek/çift
iplikçikli DNA (ss/dsDNA), sellüler transkriptaz ve virion polimeraz
kullananlarda: Hepadnaviruslarında, genomun bir kısmı tek iplikçiklidir.
Bu tek iplikçik olan kısım viriona ait DNA pol enzimi yardımı ile çift
iplikçik haline getirilir. Böylece tüm genom çift iplikçikli (dsDNA) olur.
Viral genom nukleusa transfer edilerek burada, sellüler RNA pol II enzimi aracılığı
ile dsDNA'nın değişik promotorlarından başlayan + mRNA'lar sentezlenirler
(No. IV).
05.03.
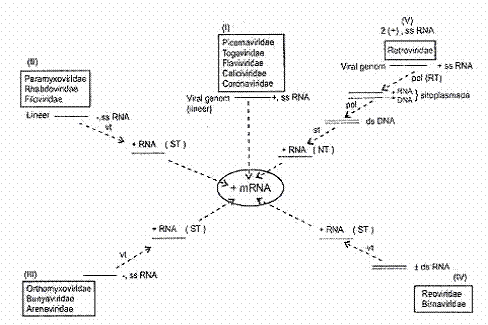
RNA Viruslarında Transkripsiyon RNA Viruslarında transkripsiyon, DNA
viruslarından daha komplikedir. Ökaryotik hücreler viral genomik RNA'dan,
mRNA sentezi için, RNA'ya bağımlı RNA polimeraz enzimine sahip olmadıkları
için, transkripsiyon da viral genomik RNA'ları kalıp olarak kullanamazlar. Bu
nedenle de, RNA virusları (ssRNA ve dsRNA), kendi genomlarında, replikasyonları
için gerekli olan enzimlerin kodlarını taşırlar (RNA'ya bağımlı RNA
polimeraz enzimi). Retroviruslar hariç tutulursa, diğer
RNA virusların transkripsiyonları hücre sitoplasmasında gerçekleştirilir.
1)
Pozitif polariteli, tek iplikçikli RNA (+, ssRNA) viruslarında: Picornaviridae,
Togaviridae ve diğerlerinde, genomlar, mRNA ile aynı polaritede olduklarından
hem infeksiyöz yeteneğe ve hem de mRNA aktivitesine sahiptirler. Bu nedenle de
genomlarında kendilerinin transkripsiyonu için transkriptaz enziminin kodlarını
taşımazlar. Viral genom doğrudan, ribosomlarda translasyona tabi tutulur
(No.I). 2) Negatif
polariteli, tek iplikçikli, virion transkriptazlı (-, ssRNA) viruslarında:
Segmentsiz tek iplikçik RNA
viruslarında, genom, kendini transkripte edebilmek için, RNA'ya bağımlı
transkriptaz enziminin kodlarını taşırlar. Bu enzim, negatif polariteli
genomik RNA'ları kalıp olarak kullanarak bunlardan pozitif polariteli RNA'ların
sentezini katalize eder. Bunlar da mRNA aktivitesine sahiptirler (+ mRNA).
(No.II). 3) Negatif
polariteli, tek iplikçikli, virion transkriptazlı (-, ssRNA) viruslarında:
Segmentli olan RNA viruslarında, her bir segment, virionda kodlanın
transkriptaz enzimi yardımı ile transkripte edilir ve bunlardan pozitif
polariteli RNA'lar oluşur. Bunlar da mRNA aktivitesi gösterirler ve
ribosomlarda translasyona tabi olurlar (No.III). 4) Çift
iplikçikli, virion transkriptazlı RNA (±, dsRNA) viruslarında:
Segmentli ve çift iplikçikli olan birnaviruslar ve reoviruslarında, genomların
negatif segmenti, viral transkriptaz enzimi yardımı ile transkripte olur ve
bunlardan pozitif polariteli RNA'lar meydana gelir. Bunlar da mRNA etkinliğine
sahiptirler (No.IV). 5) İki
molekül tek iplikçikli RNA genoma sahip pozitif polariteli, virion
transkriptazlı viruslarda (+2ss RNA): Retroviruslarında pozitif
polariteli olan genom diploid (çift
molekül) bir özellik taşır. Tek iplikçik viral genom, sitoplasmada,
virionda kodlanan revers transkriptaz
(RNA'ya bağımlı DNA polimeraz) enzimi tarafından komplementer DNA (cDNA) sentezlenerek hibrid bir molekül (RNA-DNA) oluşur. Sonrada bu, dsDNA haline
getirilir (proviral DNA). Çift
iplikçikli proviral DNA hücrenin çekirdeğine girerek kromozoma integre olur
ve burada sellüler RNA polimeraz II tarafından transkripte edilerek + m RNA
sentezlenir. Bu transkript, sitoplasmaya transfer edilir ve burada translasyona
tabi tutulur (No.V). 05.04.
Translasyon Genel anlamı ile translasyon, mRNA'da şifreler
halinde bulunan genetik bilgilerin (informasyonların) sitoplasmada ribosomlar
üzerinde deşifre edilerek (çözülerek) proteinler haline dönüştürülmesi
fenomenidir. Gen ekspresyonunun en önemli bir kısmını oluşturan
translasyon komplike bir karakter taşır. Prokaryotlarda (bakterilerde)
transkripsiyonla sentezlenen tek iplikçik mRNA polisistronik
(yani, bakterilerin m RNA'sı, genomda bulunan hemen bütün proteinlerin
şifresini taşır, ve mRNA'nın 5'-terminusunda bir promotor ve 3'-terminusunda da terminasyon sekansları bulunur) bir karakter taşımasına karşın,
ökaryotlarda monosistroniktir (her mRNA bir proteini kodlar ve her proteinin
ayrı bir promotor ve terminatör sekansları vardır). Bakteriler ve gerekse ökaryotlar,
kendi mRNA'larını, kendilerine ait olan translasyon mekanizmalarında kolayca
deşifre edip protein haline çevirmesine karşın, virusların böyle
mekanizmaları olmaması nedeniyle, viral genomda şifreler halinde (kodlanmış)
bulunan proteinlerin deşifre edilebilmesi, ancak girdiği hücreler içinde ve
hücrelerin ribosomlarında gerçekleşmektedir. Bu nedenle de virusların genom
ekspresyonları (transkripsiyon ve translasyon) ve replikasyonları ayrı bir özellik
taşımaktadır. Viruslar (hayvan virusları) bu amaçlar için ökaryotik hücrelerden
yararlanırlar. Ökaryotiklerin translasyon mekanizmaları daha komplike bir
durum gösterir ve monosistronik m RNA'ları kullanabilir. Viral m RNA'ların
da, ökaryotik ribosomlarca kullanılabilmeleri, bunların monosistronik hale
getirilmesi ile mümkündür. Diğer bir ifade ile, viral m RNA'ların ökaryotik
ribosomların çalışma mekanizmasına uymaları ve bu mekanizmalarca algılanması
gereklidir. RNA virusları 3 farklı yol izleyerek
monosistronik mRNA kuralına uyarlar. Bunlar da, 1) Segmentli genoma sahip viruslarda
(orthomyxovirus, reoviruslar) her bir genomik segment bir gen karşılığı
olarak kabul edilir ve her segmentin transkripsiyonu sonu oluşan m RNA'lar
monosistronik bir özellik taşırlar. 2) Paramyxoviruslar, togaviruslar,
rhabdoviruslar ve coronaviruslar, her genin ön kısmının (başlangıcındaki)
transkripsiyonu sonu sentezlenen mRNA'lar monosistronik özelliktedirler. 3) Picornaviruslarında pozitif
polariteli genomun 5'-terminusuna yakın kısmında tek bir ribosom bağlanma
yeri bulunmaktadır. Bu bölüm transle edilerek uzun bir poli protein
sentezlenir ve bu sonradan enzimatik olarak küçük proteinlere (monosistronik)
ayrıştırılır. Proses edilerek monosistronik bir
duruma getirilmiş ve 5'-terminusu Cap'lı olan viral mRNA'lar, bu ucu ile 40
S'lik ribosomal alt üniteye bağlanırlar. Bu alt ünite, m RNA üzerinde başlatma
kodonuna (AUG) gelinceye kadar hareket eder. Burada 60 S'lik büyük ribosomal
alt ünite ile birleşir, bir başlatma
kompleksi oluşturur ve hemen translasyon başlar. Segmentli viruslarda her segment ayrı
bir translasyona tabi tutulur. 05.05.
Erken Proteinler DNA viruslarında, mRNA'dan erken
sentezlenen proteinler arasında, çeşitli aktiviteye sahip enzimler, viral
genomun ekspresyonunu regule eden proteinler, sellüler protein sentezini ve
sellüler nukleik asit sentezini suprese eden proteinler yer almaktadır. 05.06.
Geç Proteinler Geç viral proteinler, genellikle, hücre
infeksiyonun ileri dönemlerinde ve viral replikasyondan sonra, mRNA'ların
translasyonlarından elde edilirler. Geç proteinlerin çoğu, yapısal bir
karakter taşırlar ve özellikle, regulatör fonksiyona sahip olanları,
fazlaca sentezlenirler. Bunlar, erken viral genlerin veya hücresel genlerin
transkripsiyon ve translasyonlarını regule ederler. DNA
viruslarında bazı proteinlerin sentezinin, sırasının ve miktarlarının düzenlenmesi
(regulasyonu), genellikle,
transkripsiyon aşamasında yapılır. RNA viruslarında da, yapısal olmayan
proteinler erken ve yapısal olanlar da geç sentezlenirler. Sentezin kontrolü
translasyon aşamasında yapılmasına karşın, DNA viruslarında olduğu gibi
tüm düzenlilik göstermemektedir. Caliciviruslarında, coronaviruslarında
ve togaviruslarında pozitif polariteli viral RNA'nın 5'-terminusu (bu uç, non
strüktürel proteinleri kodlar); erken translasyona tabi tutulur ve negatif
sense (polariteli) RNA'nın sentezini başlatır. Bu da subgenomik RNA' nın
transkripsiyonu için kalıp görevi yapar. Yapısal proteinler, genellikle, çok
miktarda sentezlenirler. Picornaviruslarında, caliciviruslarında
ve togaviruslarında polisistronik mRNA'lardan sentezlenen poli proteinler,
enzimatik olarak belli bölgelerinden ayrıştırılarak fonksiyonel proteinler
haline getirilirler (posttranslasyonal
modifikasyon). Hücre içinde sentezlenen proteinler
translasyon ve replikasyondaki fonksiyonlarına göre gerekli olan yerlerine
giderek reaksiyonların tam ve zamanında yapılmasını sağlarlar. Ancak, bu migrasyonu
etkin ve zamanında kontrol eden mekanizmalar tam olarak aydınlatılmış değildir.
Hücre içindeki yer değiştirmede sitoskeletonların
rolü büyüktür. Aşağıdaki tabloda viral genom tarafından
kodlanan başlıca proteinler gösterilmektedir.
06.
Nukleik Asitlerin Replikasyonları (Genom
Replikasyonu) Virusların genom replikasyonları,
genel hatları ile, bakterilerinkine benzerse de, viral genomun, DNA veya RNA
olması, çift veya tek iplikçikli, segmentli-segmentsiz, lineer-sirküler bir
özellik taşıması nedeniyle bazı farklılıklar taşımaktadırlar. Bu durum
viruslar arasında değişik stratejilerin meydana gelmesine ve uygulanmasına
yol açmıştır. 06.01.
DNA Viruslarında Replikasyon DNA virus familyalarının her birinde
ayrı bir replikasyon mekanizması uygulanmaktadır. DNA virusları
replikasyonları için gerekli olan proteinleri, enzimleri ve diğer makromolekülleri,
replikasyon başlamadan önce hücre içinde hazır olarak ve yeterince bulmaları
gereklidir. Bu proteinler viral ve/veya hücre orijinlidirler. Hücrelerce sağlananlar,
ancak hücrelerin belli zamanlarında (S fazı, DNA sentez fazı) gerçekleşmektedir.
Bu nedenle de, virusların replikasyon sırasında hücrelerin S fazına bağlılıkları
önemlidir. Ancak, bu durum viruslar arasında da değişiklik gösterir. Şöyle
ki, küçük viruslardan olan parvovirusları, infekte ettikleri hücrelerin
DNA'ları replike olurken, viral DNA'da aynı anda replike olmaya başlar. Bu yönden,
hücrelerin S-fazı bu viruslar için önem taşır. Buna karşın, büyük
virusların sellüler fonksiyona ve proteinlerine bağımlılığı daha azdır.
Çiçek virusları sitoplasmada replike olduklarından, hücrelerin S-fazına
olan gereksinimleri daha sınırlıdır. Ayrıca, viral genom, hücre
sitoplasmasında replikasyonu sağlayacak bazı gerekli enzimlerin kodlarına da
sahiptirler. Diğer DNA viruslarının da hücre (konakcı) replikasyon
mekanizmalarına olan bağımlılıkları değişiklik göstermektedir.
Parvoviruslar ve papovaviruslar replikasyonları için, konakçının DNA' sını
bağımlı DNA polimeraz enzimini kullanmasına karşın büyük viruslardan
olan adenoviruslar, herpes viruslar ve poxvirusları polimeraz enzimini kendi
genomlarında şifreler halinde taşırlar. Viral polimeraz, hücre polimerazından
daha hızlı aktiviteye sahip olmasına karşın, daha az spesifiktir. Bu
sebeple, viral enzim daha fazla mutasyonlara yol açtığı gibi antiviral ilaçlar
için de hedef bölge oluştururlar. Viruslar, her zaman, S-fazındaki hücreleri
bulamayabilirler. Bu nedenle, bazı viruslar, kodladıkları özel proteinlerle
hücreleri aktive ederek S-fazına geçmelerini uyarabilmektedirler. Replikasyonda
çok gerekli olan DNA polimeraz enzimi, viral iplikçikte primer moleküller
olmadan polimerazisyona başlatamaz. Bu enzim ancak, primerlerin varlığında
DNA'ın 3'-terminusuna (3' -OH ucuna) nukleotidleri ekleyebilir ve
polimerazisyonu sürdürebilir. Bakterilerde primerler genellikle, primaz enzimi
tarafından sentezlenen kısa (50-100 nukleotid) RNA karakterindeki tek iplikçik
oligonukleotidlerden oluşmaktadır. Viruslar bu sorunu aşabilmek için değişik
stratejiler kullanırlar. Bazılarında 5'-terminusta bulunan protein molekülü,
bir kısmında ise genomda oluşan çengel tarzdaki kıvrılma veya komplementer
uçlar replikasyon için başlangıç yerlerini oluşturarak polimeraz enziminin
bağlanmasına ve polimerizasyonuna yardımcı olurlar. Replikasyonda diğer önemli sorun da,
genomun sarmal ve süpersarmal yapısının replikasyon sırasında önceden
çözülerek replikasyona hazır bir duruma getirilmesidir. Bunun için helikaz
enzimlerinden yararlanılır. ATPase aktivitesi olan bu enzim, replikasyonun önünde
giderek DNA'yı açar (çift iplikçikli DNA) ve açılan iplikçikleri de SSBP
(single stranded binding protein) olarak tanımlanan proteinler tarafından açık
tutulması sağlanarak polimerizasyon sürdürülür. DNA polimeraz enzimi replikasyon çatalında,
açılan parental iplikçiklerinden tersine (polimeraz enziminin aktivitesine
ters yönde olanı) olanında (3'¬¾ 5') sentezi kolayca ve kesintisiz olarak sürdürür.
Çünkü, sentezlenecek olan yeni iplikçiğin yönü 5' ¾®
3' dür, yani enzimin aktivitesi yönündedir. Halbuki, açılan diğer parental
iplikçiğin yönü 5' ¾®
3' polarite gösterir. Bunun karşısında sentezlenecek olan yeni iplikçiğin
yönü ise, enzimin aktivitesine ve işleyişine ters bir durum gösterir (3' ¬¾
5'). Bu iplikçikteki polimerizasyon kesintilidir, primerler
ve okazaki segmentleri
(1000-2000 bazlık DNA molekülü) yardımları ile gerçekleştirilir.
Replikasyonun ileri aşamalarında RNA primerleri çıkartılarak bunların
yerleri DNA ile doldurulur ve aralıkları DNA ligaz ile kapatılır, ve sentez
her iki iplikçikte aynı anda tamamlanır. Çift iplikçikli DNA'nın
replikasyonu, aynı bakterilerde olduğu gibi, semikonservatiftir. Viral DNA'lar yapısal değişiklikler
(tek iplikçik, çift iplikçik lineer, sirküler) gösterdiklerinden bunların
replikasyonları arasında da bazı farklar bulunmaktadır. Aşağıda bazı DNA virus familyalarında
replikasyon mekanizmaları özetle verilmektedir. Adenoviridae:
Çift iplikçikli ve lineer bir genoma sahip olan adenoviruslarında, her iplikçiğin
5' terminusunda tersine tekrarlanan sekanslar (TIR,
terminal inverted repeat) bulunur ve her uç kovalent olarak bir
proteinle birleşmiştir. Bu proteinlerin prokürsörleri, Adeno viral DNA'nın
sentezi için primer oluştururlar. Replikasyon,
genomun iki ucundan başlar ancak asinkronize (asimetrik) bir tarzda 5' ¾®
3' yönünde devam eder. Reaksiyonu viral DNA polimeraz enzimi katalize eder.
Sentez sırasında okazaki segmentleri meydana gelmez. Adenovirusları hücrelerin
çekirdeklerinde replike olurlar. Tüm replikasyon için iki saat kadar bir süre
geçer. Hücrelerin parçalanması ile viruslar dışarı çıkarlar. Hepadnaviridae:
Bu gruba ait virusların replikasyonları hücre çekirdeğinde gerçekleşir.
Hepatitis B virusunun %70'i çift ve %30'u da tek iplikçik halindedir
(ds/ssDNA). Lineer ve çift iplikçikli bir özelliğe sahip olan viral genom,
viral DNA polimeraz enzimince, önce tam çift iplikçikli hale dönüştürülür
ve sonra da sirküler forma çevrilir. Bu replikatif formun negatif polariteli
olanı kalıp olarak kullanılarak sellüler RNA polimeraz II enzimi tarafından
transkripte edilir ve tüm genom uzunluğunda "pregenom
RNA" meydana getirilir. Böylece oluşturulan pozitif polariteli RNA
molekülünden bu defa revers transkriptaz enziminin (RNA'ya bağımlı DNA
polimerase) katalitik etkisi ile negatif sense DNA'lar sentezlenirler. Bunlar da
çift iplikçikli DNA için kalıp ödevi görürler, Böylece, tek iplikçik bölgelere
sahip çift iplikçikli (ds/ss DNA) infeksiyöz virus partikülleri oluşur. Virionun tam serbest olmadığı
durumlarda başlayan replikasyonlarda kısmi pozitif iplikçik DNA'lar
sentezlenir. Herpesviridae:
Nukleusda replike olan ve çift iplikcikli lineer bir forma sahip olan
herpesvirusları, diğer DNA viruslarından daha fazla enzime gereksinim
duyarlar. Bunların bir bölümü hücre ve diğer bir kısmı da viral
orijinlidir. Bu enzimler arasında, DNA polimeraz, helikaz, primaz, tek iplikçik
DNA bağlayan proteinler (SSBP, destabilizan proteinler), replikasyon orijinini
belirleyen ve tanıyan proteinler ve diğerleri bulunmaktadır. Viral genom sitoplasmaya ulaştığında,
çift iplikcikli sirküler forma dönüştürülür. Replikasyonun son aşamasında,
rolling circle ve bu sirküler forma bağlı olarak gelişen lineer form
(konkatamer formu) mekanizmalar
etkinlik kazanır. Oluşan lineer form, enzimatik olarak belli yerlerinden
(viral genom uzunluğunda) kesilerek projeni DNA molekülleri meydana gelir. Hücre
içinde çok sayıda böyle formların oluşması, virus üretimini arttırır.
Virusun transkripsiyon ve replikasyonu çekirdek içinde gerçekleşir. Papovaviridae:
Bu familyada bulunan DNA virusları çift iplikcikli sirküler bir özellik taşır
ve hücrelerin nukleuslarında replike olurlar. Bu familya içinde iki cins (papillomavirus
ve polyomavirus) bulunur.
Polyomaviruslarından olan Simian virus 40 (SV40) üzerinde yapılan çalışmalar
bu virusların ekspresyon ve replikasyon mekanizmaları üzerinde değerli
bilgiler elde edilmiştir. SV40 virusunun replikasyonunda hücre orijinli DNA
polimeraz alfa enziminin rolü önemlidir. Çift iplikcikli sirküler DNA'ya
sahip olan bu viruslarda replikasyon bidireksiyonal
olarak aynı anda başlar ve devam eder. Replikasyon çatalında kesintili ve
kesintisiz sentez mekanizmaları meydana gelir ve kesintili olanında da okazaki
segmentleri oluşur. Parvoviridae:
Tek
iplikçik lineer bir genoma sahip olan parvovirusları hücre içine girdikten
sonra, tek iplikçik ve lineer olan genomik DNA, çift iplikcikli sirküler
replikatif forma dönüştürülür (çekirdek içinde). Burada transkripsiyon
ve replikasyon gerçekleştirilir. Replikatif formlarda 5'-terminusunda meydana
gelen kopmalar sonu tek iplikçik konkatamerler gelişir. Bunlar da enzimatik
olarak kesilerek tek iplikçik lineer DNA molekülleri meydana gelir. Negatif
sense tek iplikçik DNA'lar ayrı ayrı kapsidler içine paketlenirler. Poxviridae:
Çift iplikcikli lineer bir özellik gösteren poxvirusları DNA'larının bütün
ekspresyon ve replikasyon aşamaları sitoplasma içinde cereyan eder. Virusun
replikasyonunda hem hücre hem de virusa ait proteinlerden yararlanılır.
Replikasyon virusun iki ucundan başlar devam ettirilir. 06.02.
RNA Viruslarında Replikasyon RNA viruslarının replikasyonlarını
tam olarak tanımlamak oldukça güçtür. Viral genomun mRNA (pozitif
polariteli RNA veya negatif polariteli RNA) olması, tek iplikcikli çift
iplikcikli, segmentli-segmentsiz olmaları bunların replikasyonlarına
etkilemekte ve değişik stratejiler kullanmalarına yol açmaktadır. RNA
viruslarının replikasyonu, infekte ettiği hücrelerde bulunmayan veya
sentezlenmeyen, bu nedenle de viral genom tarafından kodlanan RNA
polimeraz enzimi (RNA'ya bağımlı RNA polimeraz, replikaz) tarafından
katalize edilerek gerçekleştirilir. Enzim aynı zamanda, viral ekspresyonda da
görev yapar (transkriptaz). RNA
polimerazın bir özelliği de, primer olmaksızın sentezi başlatabilmesi ve
devam ettirmesidir. Ancak, picornaviruslarında genomun 5' -terminal ucuna bağlanmış
viral protein (Vgp) yeni iplikçik sentezinde primer oluşturur. RNA hücre içinde
çok çabuk ayrıştırıldığı için, RNA polimeraz enzimi, virus zarflarından
ayrılır ayrılmaz, hemen viral RNA'nın sentezine başlar. Bu enzim viral
RNA'yı kalıp olarak kullanarak buna komplementer RNA sentezler ve bu da viral
RNA'nın oluşturulması için kalıp fonksiyonu yapar.
Viral genomların pozitif veya negatif
polariteli, tek veya çift iplikcikli olduklarına göre replikasyonları arasında
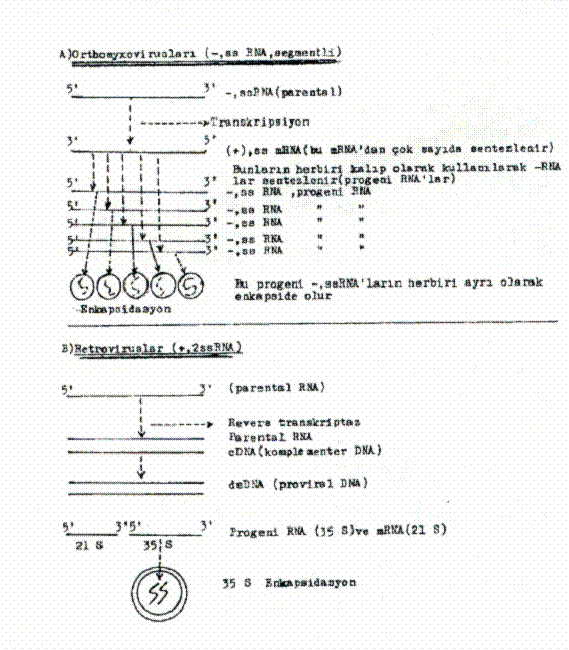
bazı farklar bulunmaktadır. 1) Negatif
sens (polarite) tek iplikcikli RNA viruslarında (-,ss RNA): Böyle
genoma sahip viruslarda (orthomyxovirus, paramyxovirus, rhabdovirus, filovirus,
arenavirus ve bunyaviruslar) viral RNA'ya hücre içinde pozitif sens
komplementer RNA sentezlenir. Bu + RNA, viral proteinlerin sentezi için m RNA
aktivitesi gösterir ve aynı zamanda, negatif RNA'ların sentezi için de kalıp
ödevi görür. Sentezlenen-RNA'lar projenileri oluşturur ve zarf içine
paketlenir. 2) Pozitif,
iki molekül tek iplikcikli RNA viruslarında (+ 2 ssRNA): Bu grupta
bulunan Retroviruslarında, genomik RNA'nın taşıdığı revers transkriptaz
enzimi (RNA'ya bağımlı DNA polimeraz) viral RNA'yı çift iplikcikli proviral
DNA'ya (pro virus DNA) çevirir.
Bu çift iplikçik ve sirküler olan proviral DNA hücre çekirdeğine girerek hücre
kromozomuna integre olur. Burada hücre enzimlerince (RNA pol II) transkripte
edilir ve oluşan tam uzunluktaki RNA'lar proses edilerek bunlardan gag, pol.,
ve env., RNA'lar oluşur. Bunlar sonradan birleşerek yeni virionu meydana
getirirler. Ancak, proses edilen RNA'lar dan 35 S olanı pozitif projeni RNA'yı
(genomu), diğeri ise (21 S) m RNA'yı teşkil eder. 3) Pozitif
sens tek iplikcikli RNA viruslarında (+, ss RNA): Bu tarzda genoma sahip
olan (picornaviruslar, caliciviruslar, togaviruslar, flaviviruslar ve
coronaviruslar) viruslarda genom pozitif sens olduğu için (+ RNA), mesenger
RNA (mRNA) aktivitesi gösterir. Direkt olarak ribosomlara bağlanarak
translasyona tabi tutulur ve protein sentezi sağlanır. Pozitif RNA, kalıp
olarak kullanılarak, RNA polimeraz enzimi tarafından negatif RNA'lar oluşturulur.
Bu RNA'lar, replikatif intermediatları teşkil ederek bunlardan fazlaca projeni
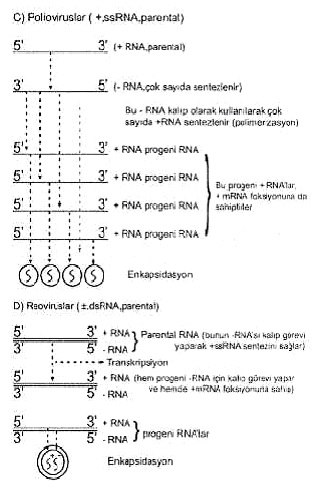
+ RNA'lar meydana getirilir ve bunlar enkapside olurlar. 4) Çift
iplikcikli segmentli RNA viruslarında (± ds RNA): Böyle genoma sahip
viruslarda (reoviruslar), her segmentin negatif olanı kalıp olarak görev
yapar ve bundan pozitif sens tek iplikçik RNA molekülleri sentezlenir. Bunlar
hem mesenger aktivitesine sahiptirler ve hem de negatif polariteli projeni RNA'nın
ikinci iplikçiğini oluşturmak için kalıp fonksiyonu yaparlar. Böylece çift
iplikcikli ± tRNA projeniler meydana gelir ve bunlar enkapside olurlar.
07.
Viral Komponentlerin Sentezleri Ve Birleştirilmesi (Asamble) Hücre içinde virus komponentlerin
sentezinden sonra, bunların tam bir olgun veya infeksiyöz virusu oluşturacak
tarzda, bir sıra ve düzen içinde bir araya getirilmesi kısa zamanda tamamlanır.
Asamblede rol alan ve enerji sağlayan bazı spesifik proteinler bulunmaktadır. Viral kapsidler boş olarak hücrenin
çeşitli yerlerinde sentezlenirler ve bu aşamadan sonra viral genom kapsid içine
paketlenirler. Genetik materyallerin kapsid içine
girmesinde özel proteinler fonksiyoneldir. 07.01.
İkosahedral (kübik simetri) Viruslarda Kübik simetrili viruslarda kapsidi oluşturan
kapsomerler hücre içinde ayrı yerlerde hazırlandıktan sonra spontan olarak
belli bir şekli oluşturmak üzere bir düzen ve sıra içinde yan yana gelir
ve kovalent bağlarla birleşerek boş kapsidi (prokapsid) meydana getirirler. Hücrede, daha önce sentezlenen
nukleik asitler de, paketleyici özel
proteinler yardımı ile, boş kapsidlerin içine girerler (enkapsidasyon).
Ancak, bazı kapsidler boş kalabildiği gibi, kapsid yapısında da defektler bulunabilmektedir. İkosahedral viruslar DNA (herpes
viruslar, adenoviruslar, papovaviruslar parvoviruslar) veya RNA
(picornaviruslar, togaviruslar, flaviviruslar, calici viruslar, reoviruslar)
karakterinde zarflı veya zarfsız olduklarına göre kapsomerlerin ve kapsidin
sentez yerleri ve asamble bölgelerinde değişiklik olabilmektedir. Adenoviruslarda, kapsomerler
sitoplasmada sentezlenirler ve buradan nukleusa geçerek çekirdek içinde birleştirilerek
kapsidi oluştururlar. Viral genom, henüz kapanmamış olan kapsidin içine
paketlenir. Herpesviruslarında, nukleokapsid nukleus içinde asamble edilir ve
nükleer membrandan tomurcuklanarak sitoplasmaya transfer edilir.
Parvoviruslarda da kapsid formasyonu nukleus içinde gerçekleştirilir.
Papovavirusları da, parvovirusları gibi genom kapsid içine nukleusda girer. RNA viruslarından olan picornaviruslarında
kapsid formasyonu sitoplasmada gerçekleştirilir ve viral genom burada kapsid içine
paketlenir. 07.02.
Helikal Simetrili Viruslarda Zarflı helikal simetriye sahip olan
viruslarda (coronaviruslar, paramyxoviruslar, rhabdoviruslar, bunyaviruslar,
arenaviruslar) sitoplasmada sentezlenen kapsomerler RNA üzerinde yan yana
gelerek helikal simetri oluştururlar. Bütün viral komponentler, sentezi ve
asamble işlemleri sitoplasmada gerçekleşir. Zarf, hücre membranlarından çıkarlarken
viriona katılır. 07.03.
Kompleks Yapılı Viruslarda Poxviruslarında ekspresyon,
replikasyon ve viral komponentlerin asamblesi sitoplasmada gerçekleştirilir. 08. Virusların Olgunlaşması (Maturasyon) İkosahedral viruslarda, viral genomun
önceden hazırlanmış olan boş kapsidin içine girmesi ile olgunlaşma
tamamlanmasına karşın, zarflı viruslarda olgunlaşma daha değişik bir
tarzda gerçekleştirilir. Özellikle, helikal simetriye sahip olan zarflı
viruslar hücre membranlarından çıkarken tomurcuklanma
sırasında membranlardan aldıkları lipid katmandan oluşan bir zarfla
kaplanarak olgunlaşırlar. Herpes virusları hücre çekirdeğinde
enkapside olduktan sonra, çekirdekten tomurcuklanma ile çıkarlarken nükleer
membrandan da bir kısım alarak sitoplasmaya transfer olur. Virus partikülleri
hemen Golgi aparatına gelir. Burada glikoproteinler proses edildikten sonra
ekzositozis ile veya hücrelerin lize olması ile de dışarı çıkabilirler. Matriks proteinine sahip olmayan bazı
viruslar (flaviviruslar, coronaviruslar, bunyaviruslar) granüler endoplasmik
retikulum (GER) veya Golgi aparatından tomurcuklanma ile olgunlaşarak
sitoplasmaya ulaşır ve burada özel vesiküllere bağlanarak plasma membranına
gelirler ve ekzositozisle dışarı çıkarlar. Çiçek virusları etrafındaki
katmanlarının sentezi viral genom tarafından kodlanır, hücreye ait bir
materyal taşımaz. Poxvirusları sitoplasmada replike olur ve olgunlaşır. Birçok zarflı virus türleri hücre
membranlarından ve bazıları da internal
membranlardan (nükleer membran,
Golgi aparatı, endoplasmik
retikulum) tomurcuklanarak
olgunlaşırlar. Şöyle ki, tomurcuklanmanın meydana geleceği yerde plasma
membranında peplomerler (dışta)
ve iç kısmında da matriks proteinleri birikmeye başlar: Bu aşamadan sonra da nukleokapsid
gelerek, sitoplasmik membranın alt kısmına yerleşir. Hücre membranında oluşan
dışarı doğru kabarma giderek artar, bir tomurcuk gelişir ve bu tomurcuk
(olgunlaşmış virus) etrafına hücre membranından bir zarf oluşur. Böylece
olgunlaşan virus hücre membranından ayrılır ve serbest kalır. Tomurcuklanma ile olgunlaşmada ve çıkışta,
hücrelerde bir zarar oluşmamaktadır. Çünkü, hücre membranı hemen tamir
edilmekte, hücreler normal yaşamlarına ve çoğalmalarına devam
etmektedirler. Böyle karaktere sahip viruslar, genellikle, non sitopatiktirler ve persistent
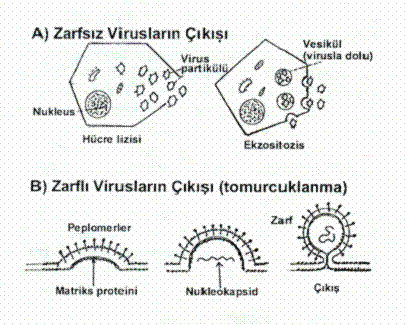
infeksiyonlara yol açarlar. Zarflı viruslarda, zarfın yüzeyinde
lokalize olan peplomerler (spike)
virus tarafından kodlanırlar. Yapıları protein, glikoprotein olmaları
nedeniyle de antijeniktirler (hemaglutinin,
neuraminidase, F-proteini)
ve vücutta antikor sentezini uyarırlar. 09.
Virusların Hücrelerden Çıkışları
(Serbest Kalma) Hücrede çeşitli tarzlarda olgunlaşan
ve infeksiyöz bir karakter taşıyan zarfsız veya zarflı viruslar (virion) başlıca
3 mekanizma ile dışarı çıkmaktadırlar.
09.01.
Hücrelerin Ölmesi (Sitolizis) İkosahedral simetriye sahip bazı
viruslar da üreme hem çabuktur ve hem de hücrelerde ölümler meydana gelir (litik
etki, sitolitik etki). Hücrelerin parçalanması ile serbest kalan
viruslar hücrelerden dışarı çıkarak başka sağlam hücreleri infekte
ederler. Picornaviruslarında, virionun oluşumundan hemen sonra hücrelerde parçalanma
meydana gelir. Nukleusda olgunlaşan bazı viruslarda, bir süre çekirdek içinde
kalabilir ve çekirdek parçalanınca ekstrasellüler ortama çıkarlar.
Herpesvirusları ise hem hücrelerin parçalanması ve/veya ekzositozisle dışarı
salınabilirler. 09.02.
Tomurcuklanma Bazı helikal simetrili viruslarda
(paramyxoviruslar orthomyxoviruslar, rhabdoviruslar, arenaviruslar,) hücrelerden
tomurcuklanma ile dışarı çıkarlar. Böyle hücreler, genellikle, hücrelerde
parçalanma (CPE) oluşturmazlar, hücreler normal yaşamlarına devam ederler
ve persistent infeksiyonlara da yol açabilirler. 09.03.
Ekzositozis Bazı zarflı viruslar (coronavirusları,
bunyaviruslar, flaviviruslar) ile herpes viruslarında sitoplasmadan çıkış
ekzositozis ile olmaktadır. Sitoplasmada serbest halde bulunan viruslar, bazı
özel vesiküllere bağlanarak hücre membranına ulaşırlar ve membrandan dışarı
ekzositozis ile çıkarlar. Aşağıdaki tabloda bazı virus familyalarında replikasyon yerleri, eklips periodu ve çıkış tarzları (membranlar) gösterilmektedir.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||