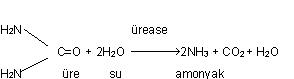|
Bazı Önemli Biyokimyasal Testler Prof. Dr. Mustafa Arda
Ankara Üniversitesi
Veteriner Fakültesi 01. Genel Bilgiler Mikroorganizmaların (bakterilerin) cins ve türlerini ayırmada serolojik, antijenik ve patojenik karakterleri yanı sıra biyokimyasal özelliklerinin belirlenmesi de çok önemlidir. Türlerin saptanmasında bu testlerin sonucuna göre karar verilir. Biyokimyasal testler çabuk yapılması, ucuz olması ve kısa zamanda sonuçlanması gibi avantajları vardır. Hatta, bazen tür tespiti sade ce biyokimyasal testlere göre yapılabilmektedir. Bu durum da, testlerin çok dikkatli, kontrollü yapılması ve çok iyi ayıraçların ve ortamların kullanılmasına bağlıdır.Bakteriler biyokimyasal aktivite yönünden oldukça farklıdırlar. Aynı cins içinde bulunan türler veya hatta aynı türün farklı bireyleri arasında bile ayrılıklar meydana gelebilir. Bu değişmeler fenotipik veya genotipik özellikte olabilirler. Ayrıca, aynı birey her zaman sabit karakter de göstermeyebilir. Bazı özellikler, test koşullarında, değişik durumlar gösterebilir. Ancak, böyle variasyonları % 1 den aşağıdadır. İşte yukarıda da açıklandığı gibi saf ve taze kültürler,
sabit ve değerli olan (güvenilebilir) standart sonuçlar verebilir ve bunlarda
tiplendirmede büyük ölçüde işe yararlar. Aşağıda mikroorganizma cinslerinin ve
türlerinin belirlenmesinde kullanılabilecek bazı önemli biyokimyasal testler
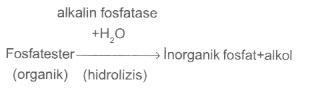
bildirilmiştir. 02. Bazı Önemli Testler 02.01. Alkalin Fosfatase Testi Bu test, bazı mikroorganizmalarca (özellikle, Pseudomonas spp.) sentezlenen alkalin fosfatase enzim aktivitesini ortaya koymada uygulanır. Fosfatase enzimi, bir fosfomonoesterase olup fosfomonoester substratı üzerine etkilidir. Fosfat esterin hidrolizasyonu sonu inorganik fosfat ve alkol (R-OH) meydana gelir.
Alkalin fosfatase enzimi, alkali pH koşullarında optimal akitviteye sahip olduğundan, bu adı almıştır. Bazıları ısıya dayanıklı olmalarına karşın, bir kısmı ise 70 °C de tahrip olmaktadır. Materyal 3) Katı besiyerinde üremiş 24 saatlik Pseudomonas spp. kültürler.Metot Uygun katı bir besiyerinde üretilmiş ve önceden Pseudomonas spp. olarak identifiye edilmiş taze kültürden bir öze dolusu alınarak, tris buffer içinde homojen bir suspansiyon yapılır (MacFarland no 3 (9x108 hücre/ml), bundan 1 ml alınarak iki tüpe 0.5 ml miktarında taksim edilir (tüp-1 ve -2). Tüplerden biri (tüp-1), su banyosuna (70 °C) 20 dakika süre için konulur. Diğer tüp (2) ısıtılmadan oda sıcaklığında bırakılır (kontrol).Yirmi dakikanın sonunda, her iki tüpe 0.5 ml miktarında % 0.1 p-nitrophenyl phosphate solusyonu (renksiz) konur ve iyice karıştırıldıktan sonra her iki tüp 37 °C de inkubasyona bırakılır. Bu süre bir saat ile 24 saat arasında değişebilir. Kuvvetli pozitif reaksiyonlar, genellikle, bir saat içinde ve koyu bir sarı renkte ortaya çıkar. Değerlendirme Tüplerin herhangi birinde sarı bir renk
meydana gelmemiş ise, negatif olarak değerlendirilebilir. Ancak, böyle durumlarda, 24
saat kadar beklemek ve sonra karar vermek daha doğrudur. Sarı renk pozitif reaksiyonu
ifade eder.
Dikkat edilecek noktalar 1. Teste, pozitif (P. aeruginosa) ve negatif (S. epidermidis) kültürleri de kontrol olarak iştirak ettirilir ve
değerlendirmeler bunlara bakılarak gözle yapılır. 02.02. Beta Galaktosidase (ONPG) Testi Bu test, o-nitrophenyl - beta-D-galactoside'in (ONPG) ayrışmasını katalize eden beta-galaktosidase enziminin varlığının belirlenmesi amacıyla yapılmaktadır. Beta galaktosidase ortamda bulanan basit galoktozid'leri (laktoz dahil) ayrıştıran ve indüklenebilen intrasellüler bir enzimdir. Bakterilerin, laktozu fermantasyon kabiliyeti, ortamda bulunan ONPG 'nin ayrışması için gerekli olan beta-galaktosidase enziminin varlığına bağlıdır. Eğer besiyerinde galaktosidase pozitif bir bakteri varsa, renksiz olan ONPG hidrolize edilerek, sarı kromojenik bir madde olan O-nitrofenol (ONP) serbest kalır. Pozitif reaksiyon da bu maddenin tespiti üzerine dayanır. Serbest kalan o-nitrofenol, alkali bir solusyonda bulunursa, tautometrik değişmelere maruz kalarak sarı renk meydana getirir.
Bu reaksiyon, özellikle, laktozu geç parçalayan veya şüpheli reaksiyon veren mikroorganizmalara kesinlik kazandırmada işe yarar. Böyle bakterilerin çoğu ß -galaktosidase pozitif reaksiyon vermektedirler. Pozitif reaksiyon laktozun fermente olduğunu gösterir.Materyal 1) İçinde ONPG bulunan 5 ml miktarında sıvı besiyeri. Metot ONPG brothda mikroorganizmalar bolca ekildikten sonra 37 °C de 18-24 saat inkubasyona bırakılırlar. Sürenin sonunda kültürler santrifuje edilerek üst taraf atılır. Bakteri tortusuna 0.25 ml fizyolojik su ilave edilerek homojen bir suspansiyon yapılır. Buna bir damla toluene konularak iyice çalkalanır. Tüp 37 °C de 5-10 dakika su banyosuna bırakılır. Sonra, buna 0.25 ml ONPG solusyonu katılır ve tekrar su banyosuna 20 dakika ile 24 saat süre ile konulur. Tüplerdeki renk değiş imine dikkat edilir. Tüplerde 20 dakika içinde bir değişiklik yoksa inkubasyona devam edilir.Değerlendirme Tüplerde sarı rengin meydana gelmesi ONPG nin hidrolize edildiğini (pozitif reaksiyon) ve renksiz olması da negatif reaksiyonu gösterir. Dikkat Edilecek Noktalar 1) Kimyasal maddeler (ONPG, toluene, NaCl, vs.) saf ve en iyi kalitede
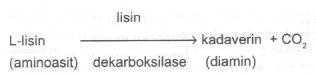
olmalıdır. 02.03. Dekarboksilase Testi (arginin-lisin-ornitin) Bu test, mikroorganizmaların, aminoasitlerdeki karboksil grubunu enzimatik olarak ayrıştırarak (dekarboksilasyon) amin ve korbondioksit meydana getirebilme yeteneğini belirlemek için kullanılır. Reaksiyon, dekarboksilase enzimi yardımıyla katalize edilir. Aminin meydana gelmesi ortamın pH sını yükseltir.
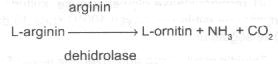
Bir aminoasit olan L-arginin başlıca 2 tarzda katabolize olur (arginin dehidrolase ve arginin dekarboksilase sistemleri).
Yukarıdaki her iki reaksiyonda oluşan L-ornitin ve agmatin de daha ileri derecelere kadar katabolize olarak amin ve karbondioksite ayrışabilir. Dekarboksilase testi için bazı yöntemler (Moller, Falkow, vs.) geliştirilmiştir. Burada sadece Moller yöntemi bildirilmiştir. Materyal 1) Her birinde ayrı ayrı % 1 oranında L-arginin, L-lisin ve
L-ornitin bulunan 4-5 ml miktarında Miller ortamında birer tüp ve bir adet de kontrol
(amino asitsiz) besiyeri, tüplerin üzerine 5 mm kalınlığında steril parafin konur. Metot Miller besiyerinin her birine, taze saf kültürlerden yeterince ekilir ve tüpler 37°C de 2-7 gün bırakılır. Kültürler her gün muayene edilir. Besiyerinde, önce glikozun fermantasyonu sonucu azot oluşması nedeniyle sarı bir renk meydana gelir. Sonra dekarboksilasyon meydana gelerek amin teşekkül eder ve besiyerinin pH sı yükselir ve mor bir renk alır (pozitif reaksiyon). Değerlendirme Pozitif reaksiyon : Dikkat Edilecek Noktalar 1) Argininli tüpte pozitif reaksiyon meydana geldiğinde, besiyerinde amonyak (NH 3) varlığı yönünden Nessler ayıracı ile kontrol edilmelidir.2) Tüpler inkubasyonda uzun süre kalınca sarı ve mor renk meydana gelebilir. Bu durumda değerlendirmeden önce tüp hafifçe çalkalanmalıdır. 3) Tüplerin üzeri iyice işaretlenmelidir. 4) Amino asit içermeyen kontrol tüp, içindeki glikozun fermantasyonu sonu sarı renk göstermelidir. 5) Tüplerin değerlendirmesi 24 saatten önce yapılmalıdır. Çünkü, ilk defa sarı renk gösteren tüpler sonradan mor renk alırlar. 6) S. gallinarum, orinitini geç dekarboksilize eder (5-6 gün). 7) Tüplerin üstünde parafin bulunmalıdır. Çünkü, reaksiyon anaerobik koşullarda meydana gelir. Parafin, ekim yapıldıktan sonra ilave edildiği gibi, ekimden önce vasatla birlikte de sterilize edilebilir. 02.04. Deoksiribonuklease (Dnase) ve Termonuklease Testleri Bu test, mikroorganizmaların ısıya dayanıklı olan deoksiribonuklease (DNase) enzimini sentezleyebilme yeteneklerini ölçmede kullanılır. Enzim, hücre çekirdeklerinde bulunan deoksiribonukleik asidi (DNA) depolimerize ederek ayrıştırır. Ayrıca, S. aureus 'ların DNase'lerinin ısı karşısında termonuklease stabilitesini ölçmede de yararlanılır. DNase aktivitesi, özellikle, koagulaz negatif reaksiyon veren S. aureus 'ların patojenitelerini tayinde yardımcı olur. Bu yönden, S. aureus (+) ve S. epidermidis (-) dir. Ayrıca, birbirlerine yakın pigment vermeyen genuslardan Klebsiella Enterobacter Serratia 'ları ayırmada da kullanılır (Serratia spp. (+) Klebsiella ve Enterobacter (-) dir. Termonuklease testinde, ısı karşısında, S. aureus tarafından sentezlenen DNase varlığı ortaya konur ve S. epidermidis ve diğer mikrokokların oluşturduklarından farkı ortaya konur. Nuklease enzimleri başlıca iki karakter taşır.1) Endonuklease'ler internal pozisyonda bulunan fosfodiester bağlarını ayrıştırır. 2) Ekzonuklease'ler ise DNA molekülü terminusunda bulunan nukleotid'leri hidrolize eder. DNase, DNA'yı depolimerize ettiği gibi, aynı zamanda polimerizasyonu da katalize eden bir enzimdir. DNase'ler birçok mikroorganizmanın ekstraksiyonundan elde edilebilir. Ekstrasellüler karakterde olanlar, S. aureus, grup A streptokok, C. diphteriae, S. marcescens, P. aeruginosa, Bacillus spp. ve Vibrio spp. 'den izole edildiği bildirilmiştir. Stafilokokkal DNase'ler hem S. aureus ve hem de S. epidermidis 'den elde edilmiştir. Bunlardan S. aureus 'unki ısıya dayanıklıdır (100 °C 15 dakika). Serratia DNase'leri nonspesifik fosfodiesterase'lerdir.S. aureus ile Serratia marcescens DNase'leri arasındaki farklar aşağıda gösterilmiştir.
Materyal Kültür filtratlarında bulunan ekstrasellüler DNaseyi ölçmede
aşağıdaki materyal kullanılır. Metot İncelenecek mikroorganizma kültürlerinden, petri kutusunda ki Toluidin mavisi DNA agar üzerine ortasına (bir noktaya) veya çizgi tarzında ekim yapılır. Petri kutusu 37 °C'de 2-3 gün inkube edilir. Bu sürenin sonunda, ekimin yapıldığı yerlerde üremenin etrafında parlak pembe bir açıklık meydana gelir. Eğer, besiyerinde Toluidin mavisi yoksa o zaman HCl (1 N, solusyonu agar üzerine yayılır. Değerlendirme 1) Toluidin mavisi DNA agar üzerinde
üreme etrafında parlak pembe açık sahanın oluşması DNase pozitif olarak
değerlendirilir. Negatif olgularda bir değişiklik görülmez.
Dikkat Edilecek Noktalar 1) Kültürler taze olmalı ve yeterli bir üreme meydana gelmelidir.2) Deneme çift olarak düzenlenmeli ve hem DNase ve hem de termonuklease akitvite ölçülmelidir. 3) DNase'lerin çoğu aktiviteleri için besiyerlerinde divalan katyonlara gereksinimleri vardır. 4) Negatif durumlarda, gerektiğinde inkubasyon süreleri uzatılabilir. 02.05. Eskülin Ayrışması Testi Bu test, S. agalactiae ile S. faecalis 'i birbirinden ayırmada işe yarar. Bir glikozid olan eskulin, etkenlerin enzimleri vasıtasıyla hidrolize edilerek ayrıştırılır. Deney, eskulinli buyyon veya agarda uygulanabilir. Materyal 1) İçinde eskulin bulunan buyyon (eskulinli buyyon, 5 ml) veya katı
besiyeri (eskulinli agar) Metot Üremiş mikroorganizmalardan sıvı ve katı besiyerlerine ekimler yapılarak 37°C 1-7 gün kadar inkube edilir.Kültürler her gün gözle kontrol edilirler. Değerlendirme 1) Katı besiyerinde koloni etrafında oluşan siyahlanma eskulinin
hidrolize olduğunu ifade eder (pozitif reaksiyon). Negatif durumlarda, hiçbir
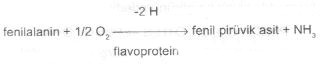
değişiklik görülmez. 02.06. Fenilalanin Deaminase Testi Bu test, mikroorganizmaların enzimatik akitviteleri ile aromatik bir aminoasit olan fenilalanini oksidatif deamine ederek fenil pirüvik asit meydana getirebilme yeteneklerini ölçmede kullanılır.
Materyal 1) İçinde DL-fenilalanin buluan katı besi yeri (pH 7.3, 5 ml) Metot Mikroorganizmalar ekildikten sonra tüpler 37 °C de 1-5 gün kadar inkubasyonda bırakılırlar. Sonra üzerilerine ayıraçtan 4-5 damla katılır ve tüpler hafifçe döndürülü r (1-5 dakika).Değerlendirme Ayıraç ilavesinden sonra tüplerde kültürlerde ve solusyon içinde yeşil rengin meydana gelmesi pozitif olarak kabul edilir. Negatif durumda sadece ayıracın sarı rengi görülür. Dikkat edilecek noktalar 1) Ayıraç taze hazırlanmalı ve önceden kontrol edilmelidir.
Çözelti kahve renkli şişelerde ve buzdolabı sıcaklığında (+4°C) muhafaza
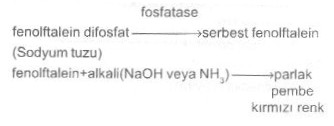
edilebilir. 02.07. Fosfatase Testi Bu test, özellikle, stafilokokların (koagulase pozitif) sentezledikleri fosfatase enzimini belirlemek amacıyla yapılır.
Materyal 1) İçinde, % 0.5 fenolftalein disfofat bulunan agar besi yeri (pH
7.3) Metot Mikroorganizma kültürlerinden fenolftalein fosfatlı agara ekim yapılır ve 37 °C de 1-2 gün inkube edilir. Bu sürenin sonunda, koloniler amonyak buharına tutulurlar (petri kutusunun kapağına 1 ml NH 4OH konur ve kültür ters olarak kapatılır). Eğer sıvı besiyeri kullanılmışsa, tüplere sodyum hidrositten bir damla damlatılır.Değerlendirme Kolonilerde veya tüpte kırmızı rengin meydana gelmesi pozitif reaksiyonu gösterir. Negatif durumda renk değişikliği olmaz. Dikkat edilecek noktalar Alkali ilavesi çok az veya çok fazla olmamalıdır. Yanlış sonuç verebilir. 02.08. Glukonat Oksidasyon Testi Bu test, mikroorganizmaların glukonat (glukonik acid) okside edebilme yeteneğini ölçmede kullanılır. Glukonat'ın ayrışması sonu besi yerinde oluşan 2 ketoglukonat, ayrıçla ortaya konulur. Bu deneyden mikroorganizma cinslerini [ E. coli (-), Enterobacter (+), Klebsiella (+) ve P. aeruginosa (+)] identifikasyonunda yararlanılır.Materyal 1) İçinde glukonat (potasyum glukonat, potasyum glukonik asit)
bulunan sıvı besi yeri (5 ml tüplerde), Metot Mikroorganizmalardan yeteri miktarda glukonatlı besi yerlerine ekilir ve 37 °C de 2-3 gün inkübe edilirler. Bu sürenin sonunda kültürlere Benedict ayıracından 1 ml konur ve iyice karıştırılırlar. Sonra 100 °C de su bany osunda 10 dakika bekletildikten sonra okunur.Değerlendirme Tüplerde kahverengi - esmer renkte bir presipitasyonun meydana gelmesi pozitif reaksiyon olarak değerlendirilir. Negatif olgularda ayıracın renginde (mavi) bir değişiklik olamaz. Meydana gelen pr esipitat genellikle renksiz bir görünümdedir.
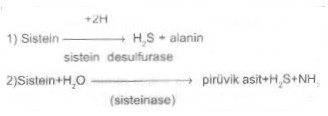
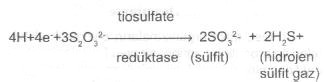
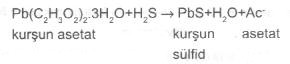
02.09. Hidrojen Sulfid Testi Bu test, mikroorganizmaların, sülfür içeren bazı aminoasitleri (sistin, sistein, metionin, glutation) veya bileşikler (sülfatları) ayrıştırarak hidrojen sülfür (H 2S) meydana getirebilme durumlarını saptamak için yapılır.
Kurşun sulfatla birleşince kurşun sülfid meydana gelir ki bu madde siyah bir görünümdedir. Ortama indikatör olarak demir bileşiklerinin konulduğu durumlarda (örn, SIM besi yeri) demir sulfid (FeS) oluşarak siyah renk teşekkül eder. Hidrojen sulfid deneyinde, ya besi yerinden dışarı çıkan veya besi yeri içinde kalan hidrojen sülfid saptanır. Bu duruma göre de yöntemler değişebilir. Besi yerinde oluşan hidrojen sülfüri ortaya koymada, TSI (triple sugar iron agar), Kligler demirli Agar (KDA) Sulfid İndol-Motile (SIM) yarı katı agar, pepton iron agar (PIA) Bismut Sulfid Agar (BSA) vs. katı veya yarı katı besiyerlerinden yararlanılır. Bunların hepsinde kükürt, sodyum tiosulfat (Na 2S2O3) bileşiği halindedir. Oluşan kükürtlü hidrojeni ortaya koymada indikatör olarak ferro sulfat (FeSO4), ya da ferroamonyum sulfat (Fe (NH4)2 SO4), ferrik sulfat (FeC6H5O7) halindedir.Besi yerinden dışarı çıkan kükürtlü hidrojeni belirlemede ise, kurşun asetat emdirilmiş steril kağıt şeritlerden yararlanılır. Materyal 1) Tüpte hazırlanmış SIM yarı katı besi yeri (bu ortam hidrojen
sülfürü ortaya koyması yanı sıra indol ve hareket muayenesi için de kullanılır). Metot 1) SIM besi yerine, mikroorganizma kültürleri batırılmış iğne
ile dikine ekim yapılır. Değerlendirme 1) SIM besi yerinde, inokulasyon hattı
boyunca siyah rengin (demir sulfid, FeS) meydana gelmesi pozitif reaksioyn olarak
değerlendirilir. Hiçbir değişiklik yoksa negatif olarak kabul edilir. 2) Eğer sıvı ortamdan H2S çıkarsa, kağıttaki kurşun asetatla temasta kurşun sulfid meydana gelir ve kağıdın uç kısımları kararır (pozitif reaksiyon). Kağıtta hiç bir kararma yoksa negatif olarak değerlendirilebilir. Ancak, bu durumda sıvı kültüre 0.5 cc 2N HCl ilave edilir ve tekrar kağıt şerit konur. Kültür içinde H2S kalmışsa hemen dışarı çıkar ve kağıt kararır. Bu zaman yine pozitif olarak kabul edilir. Dikkat edilecek hususlar 1) Yöntemlerin kullanılması araştırıcıya bağlıdır.
Gerektiğinde her iki yöntemden de yararlanılabilir.
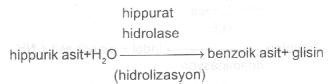
02.10. Hippurat Hidrolizasyon Testi Bu test, bazı bakterilerce sentezlenen hippurat hidrolase (hippurilase) enzimi yardımıyla sodyum hippurat'ı (hippurik asit) hidrolize ederek benzoik asit ve glisin'e ayrıştırma yeteneğini belirlemede kullanılır.
Materyal 1) Tüp içinde sodyum hippurat buyyonu (veya hippurat agar) Metot 1) Kültürlerden, hippuratlı buyyonlara ekim yapılarak 37 °C de 4-5
gün inkubasyona bırakılır. Değerlendirme 1) Eğer hippurat ayrışarak fazla benzoik asit meydana gelmişse ve
katılan indikatörlerle kahve renkli ve çalkalanınca erimeyen fazla bir presipitat
meydana gelirse (pozitif reaksiyon). Eğer, presipitat oluşursa ve çalkalanır da hemen
erirse veya hafif bir bulanıklık ve opelesans olursa negatif olarak değerlendirilir. Dikkat edilecek noktalar 1) Test, önceden ß-hemolitik streptokok
olarak belirlenen etkenler de uygulanmalıdır. Ancak bu test sadece streptokoklar için
değildir. Diğer mikroorganizmalar da hippuratı ayrıştırabilirler.
02.11. İndol Testi Bu test, mikroorganizmaların bir aminoasit olan triptofanı ayrıştırarak indol meydana getirebilme yeteneğini belirlemek için kullanılır.
Materyal 1) İçinde triptofan bulunan sıvı besi yeri veya peptonlu su
(tüpte, 5 ml). Metot Mikroorganizmalar sıvı besi yerine veya peptonlu sıvıya ekildikten sonra 37 °C de 1-5 gün inkubasyona bırakılır. Kültürlerin üzerine kovacs (veya Ehrlich) ayıracından 0.5 ml ilave edilir ve iyice karıştırılır. Değerlendirme Tüplerin üst kısmında bir iki dakika içinde kırmızı bir halkanın oluşması pozitif reaksiyon (indol formasyonunu) ifade eder. Sarımsı halka indolun oluşmadığını gösterir (negatif indol testi). Renk, indol içinde bulunan pyrrole'den ileri gelir. Dikkat edilecek noktalar 1) Ayıraçlar taze olmalı ve önceden iyice kontrol edilmelidir. 02.12. Jelatin Hidrolizasyon Testi Bu test, mikroorganizmaların, jelatini hidrolize eden jelatinase enzim sentez yeteneğini ölçmede kullanılır. Bakterilerin identifikasyonunda işe yarar. Jelatin protein karakterinde bir madde olup kollagenin hidrolizasyonundan elde edilir.
Uzun süre yüksek ısıda bulanan jelatin kısmen hidrolize olur ve katılaşma özelliğini kaybeder. Materyal Jelatinin hidrolizasyonunu saptamak için bir çok besi yerleri
geliştirilmiştir. Bunlardan basit olanı tüplerde uygulanmaktadır. Metot Mikroorganizma kültürlerinde değdirilmiş olan iğne, dik olarak jelatinli besi yerlerine daldırılır (yeterince ekim yapılmalıdır). Tüpler 37°C de 15 gün kadar inkube edilir. Bu süre sonunda kontrollerle birlikte buz dolabı sıcaklığında 1-2 saat bırakılır. Erimenin olup olmadığına dikkat edilir. Bu besi yerinde mikroorganizmalar iyi üre mez ise diğer testler denenebilir (Frazier jelatin agar besi yeri).Değerlendirme Jelatinin hidrolize edildiği durumlarda, buzdolabından çıkarılınca, jelatinli ortamın sıvı halinde ve katılaşmadığı görülür (pozitif jelatin hidrolizasyonu). Negatif durumlarda tüpteki sıvı jelatinli besi yeri katılaşır. Dikkat edilecek noktalar 1) İçinde % 12-14 jelatin bulunan broth oda sıcaklığında katı
olmasına karşın 37°C de sıvı haline dönüşür. Bu nedenle, değerlendirmeyi
buzdolabında tutulduktan sonra yapmak gerekir. 02.13. Karbonhidrat Fermentasyon Testi Bu test, mikroorganizmaların çeşitli spesifik karbonhidratları ayrıştırma yeteneklerini (sakkarolitik aktivite) belirlemek amacı ile yapılmaktadır. Mikroorganizmalar karbonhidratları, kendileri tarafından sentezlenen hidrolase (karbohidrase) enzimleri yardımı ile ayrıştırırlar. Ancak bu yetenek mikroplar arasında oldukça fazla değişiklik gösterdiği gibi, bir türe ait mikroorganizmalar arasında da ayrı fermentasyon özelliği gösteren variant suşlar da meydana çıkmaktadır. Bazı mikroorganizmaların fermentasyon özelliği yok denecek kadar az olmasına karşın Enterobacteriaceae familyasına ait olanlarda bu aktivite oldukça yüksektir.Karbonhidratlar (monosakkarid, polisakkarid ve alkoller), bakteriler tarafından değişik tarzda (aerobik ve anaerobik) ayrıştırılarak çeşitli ürünler, organik asitler (asetik asit, butirik asit, formik asit , laktik asit, propionik asit, suksinik asit, vs.), nötral ürünler (Asetilmetilkarbinol, 2,3-butilenglikol, aseton, etil alkol, isopropil alkol, butil alkol, vs.) ve gazlar (hidrojen, oksijen, metan, karbondioksit) meydana gelirler.Bu maddeler çeşitli testler yardımı ile ortaya konabilir ve mikroorganizmaların identifikasyonunda önemli göreve sahip olurlar. Enerji ve karbon kaynağı olarak, karbonhidratların önemi fazladır. Metabolize olabilenlerin üreme üzerine olumlu etkileri vardır. Ancak, ayrışma son u oluşan organik asitler, besi yerinin pH sını düşürerek belli bir süre sonra üremeyi sınırlar ve durdururlar. Bu yönden de zararlı etkisi olur. Karbonhidratların aerobik ayrışması sonu çok fazla enerji ortaya çıkmasına karşın anaerobik ayrışmada (fermentasyon) enerji daha az çıkmakta ve organik asit oluşumu daha fazla görülmektedir. Laboratuvarlarda kullanılan besi yerleri ve diğer koşulların etkisi altında, mikroorganizma türlerine göre değişmek üzere, karbonhidratların ayrışması, genellikle, 1-10 gün arasında değişmektedir. Bazen daha uzun bir süreye gereksinim duyulabilir. Ayrışmayı ortaya koyabilmek için besi yerlerine üreme üzerine olumsuz etkisi olmayacak yoğunlukta bazı indikatörler (Andrade, bromkrezol moru, brom timol mavisi, fenol kırmızısı, vs.) katılır. Bunların özelliklerine göre renklerinde meydana gelen değişmeler ayrışmayı ve derecesini belirtir. Bu indikatörler besi yerlerine, yukarıdaki sıraya göre, % .005, % 0.0025, % 0.001 son konsentrasyonda olacak tarzda ilave edilirler. Andrade hariç olmak üzere diğerleri asit ortamlarda sarı renk meydana getirirler. Besi yerlerinde gaz oluşumunu saptamada, tersine yerleştirilmiş küçük Durham tüplerinden yararlanılır. Gaz, bu tüpün üst tarafında birikir. Bu amaçla özel Smith tüpleri de kullanılabilir. Nötral ürünlerden asetoin'i (asetil metilkarbinol) saptamada Voges Proskauer (VP) reaksiyonu laboratuvarlarca benimsenmektedir.Materyal 1) İçinde % 1 oranında çeşitli
karbonhidratları içeren indikatörlü ve Durham tüplü steril peptonlu su veya uygun
bir sıvı besi yeri (4-5 ml). Durham tüpleri genelilkle glikoz'lu besi yerine
konmaktadır (Salicin % 0.5, olarak hazırlanır). Metotİyi üremiş saf kültürlerden 0.1 ml kadar alınarak ayrı ayrı karbonhidrat içeren tüplere ekilir ve iyice karıştırıldıktan sonra tüpler 37 °C de inkubasyona (1-10 gün) bırakılırlar. Tüpler her gün sabah-akşam, gaz ve asit oluşumu önünden muayene edilerek, kontrollerle birlikte, gözle değerlendirilirler. Gerektiği hallerde okuma süresi uzatılabilir. DeğerlendirmeKullanılan indikatörün özelliğine göre aşağıdaki tarzda karar verilir:
Yukarıda bildirilen renk değişmeleri pH durumlarına göre oldukça fazla farklılıklar göstermektedir. Bunları dikkate almak gereklidir. Dikkat edilecek noktalar 1) Bazı peptonlar bileşimlerinde
karbonhidrat içerdiğinden, bu test için uygun değildirler. Bu yönden dikkatli
bulunmak gerekir. 02.14. Katalase Testi Bu test, bazı mikroorganizmalarca sentezlenen katalase enzimini (hidrojenperosid oksidoredüktase) saptamak amacıyla yapılır ve identifikasyonda kullanılır. Bu enzim ekseri sitokrom ihtiva eden aerobik bakterilerde ve bazı fakültatiflerde bulunur. Katalase bir hemeprotein olup prostetik grubunda, her molekülde, 4 atomlu ve 3 değerli demir (Fe+++) bulunur. Enzim, hidrojen peroksid'i (H2O2) su (H2O) ve oksijene (O2) ayrıştırır. Hidrojen peroksidin ayrışmasında, bir molekülü substrate donor olarak görev yapar.
Bakterilerde hidrojen peroksidin ayrışmasında başlıca iki enzim etkili olabilmektedir. Bunlardan biri, katalase ve diğeri de peroksidase'dir. Hidrojen peroksidin dışında diğer bazı substratlar da katalase enzimi tarafından kullanılabilirler. Bunlar arasında, alkoller (etanol), hidratlanmış formaldehid (H 2C(OH2), nötröz asidi (HNO2) ve formik asit (HCOOH) vardır. Katalase enzimi, hidrojenperoksidi, metilalkol'u (CH3OH) ve etlalkol'u (C2H5OH) okside etmek için kullanılabilir.Materyal 1) Taze hazırlanmış hidrojen peroksid
solusyonları (% 3 ve % 30) Metot 1) Katı besi yerinde (kanlı agar hariç)
üremiş olan mikroorganizma kolonilerinden platin öze (veya cam baget) yardımı ile
yeterli miktarda alınarak temiz ve yağsız bir lamın üzerine konulur. Sonra buna % 30
luk hidrojen peroksidden bir damla damlatılır veya Değerlendirme Hidrojenperoksid katılmasından sonra kabarcıkların görülmesi veya çıkması pozitif reakiyon olarak değerlendirilir. Şüpheli durumlarda mikroskop altında muayene yapılabilir. Reaksiyon en iyi pH 7.0 da meydana gelir ve oda sıcaklığında yapılır. Sonuçlar, negatif (-), zayıf (+), orta (++) ve kuvvetli (+++) pozitif olarak derecelendirilir. Dikkat edilecek hususlar 1) Mikroorganizmaları üretmede
kullanılan katı besi yerinde kan bulunmamalıdır. Bunun yerine, eğer zorunlu ise,
çikolata agar denenebilir. 02.15. Kazein Hidrolizasyon TestiBu test, sütün proteinini oluşturan ve kolloidal karakterde bulunan kazeinin, bakterilerce sentezlenen, proteolitik ve ekstrasellüler bir enzim olan protease tarafından hidrolize edilebilme durumunu saptamak için kullanılır. Mikroorganizmaların türlerinin identifikasyonunda işe yarar. Materyal 1) İçinde % 10 yağsız süt bulunan
agar (sütlü agar) Metot Sütlü agar besi yerine çizgi tarzında mikroorganizmalar ekilir ve petri kutusu 37°C de 2-14 gün kadar inkubasyona bırakılır. Petri kutuları her gün, kontrollerle karşılaştırılarak, muayene edilirler. DeğerlendirmeSüre sonunda koloniler etrafında oluşan açık alan, sütteki kazeinin hidrolize olduğunu ifade eder (pozitif reaksiyon). Negatif durumlarda koloni etrafında hafif opaklaşma görülür. Dikkat edilecek noktalar 1) Sonucu iyi değerlendirmek için Petri kutuları siyah bir zemin
üzerine konulur. 02.16. Koagulase Testi Bu test, özelilkle stafilokoklarda bulunan ve kan plazmasını pıhtılaştıran koagulase enzimini (stafilokoagulase) ortaya koyma, patojenik olanlarla nonpatojenik olanları ayırmak amacı ile yapılır. Patojenik olan S. aureus pozitif reaksiyon vermesine karşın S. epidermidis ve S. saprophyticus negatif reaksiyon gösterir. Aslında koagulase'nin patojenite ile ilişkisi de tam olarak aydınlatılmamıştır.
Bazı araştırmacılar, koagulase enzimini, normal plasma faktörü ile reaksiyon vererek trombin benzeri subtansı oluşturan ve protrombin benzeri bir madde olduğunu da bildirmişlerdir. Bu madde sonradan fibrinojen'i aktive ederek fibrin haline dönüştürür. Stafilokoklar dışında bazı mikroorganizmalar da koagulasyon meydana getirebildikleri saptanmıştır. Ancak buradaki reaksiyon en zimatik olmayıp, plasma antikoagulatanın tahrip olması etkisinin ortadan kalkmasıyla meydana gelir. Koagulase enziminin fazla olması reaksiyonun daha çabuk ve belirgin olarak meydana gelmesine neden olur. Stafilokoklarda koagulase aktivitesinin, bu etkenlerinin oluşturduğu diğer toksik substanslarla bir bağlantısı olmadığı bildirilmiştir.Materyal 1) Steril taze insan veya tavşan
plasması (heparinli veya fibrinojen) Metot 1. Tüpte test: Temiz bir tüpe (13 x 100 mm) 0.5 ml kadar plasma konur. Üzerine aynı miktar S. aureus kültürlerinden damlatılır ve homojenize edilir. Sıvı kültür yerine, katı besi yerinden alınmış bir-iki saf koloni de, plasma içinde homojen bir suspansiyon yapılabilir. Eğer elde yeterince plasma varsa, bu amaç için iki ayrı tüp kullanılabilir.Tüpler 37 °C de su banyosunda 1-3-6 saat tutulur ve her saat gözle kontrol edilirler.Tüpler çok hafifçe eğilerek koagulasyon durumu belirlenir.2. Lamda test: Temiz bir lam üzerine bir damla steril fizyolojik su (veya distile su) konur. Buna taze sıvı stafilokok kültüründen bir damla ilave edilir veya agardan bir-iki koloni alınarak sıvı ile bir suspansiyon yapılır. Sonra bunun üzerine bir damla steril taze plasma konur ve homojenize edilir. Reaksiyon 3-5 saniye içinde okunabilir. Şüpheli durumlarda sonucu almak için 2-3 dakika kadar beklenebilir. Değerlendirme 1. Tüp testinde: Tüp içinde bulunan
plasmanın tam pıhtılaşması (fibrin oluşumu) pozitif reaksiyon olarak
değerlendirilir. Eğer fibrin oluşumu tam değilse (kısmi koagulasyon) 24 saat 35° -
37° C de tekrar bekletilmelidir. Hiçbir pıhtılaşma yoksa, suspansiyon ilk baştaki gibi homojen ise, negatif reaksiyon olarak kabul edilir. Gerekirse,
24 saat yeniden inkubasyona bırakılabilir. Değerlendirme kontrollerle
karşılaştırılarak yapılır. Dikkat edilecek noktalar 1) Testte eski ve zayıf üreyen
kültürler kullanılmamalıdır, geç ve şüpheli reaksiyonlar görülebilir. 02.17. Lesitinase (lipid hidrolizasyon) Testi Bu test, yumurta sarısında bulunan lipoprotein komplekslerinin bakteriler tarafından oluşturulan lesitinase ve fosfolipase enzimleri ile hidrolize edilebilme durumunu belirlemek için yapılır. Materyal 1) Yumurta sarılı agar Metot Mikroplar yumurta sarılı besi yerine ekildikten sonra 37°C de 1-7 gün inkube edilirler. Kolonilerin etrafındaki açılmalara dikkat edilir. Değerlendirme Koloniler etrafında lesitin hidrolizasyonu sonu oluşan açılmalar ve opaklaşmalar pozitif olarak değerlendirilir. Bu alanın çapı mm olarak ölçülür. 02.18. Litmuslu Süt Testi Bu test, mikroorganizmaların litmus katılmış sütte üremelerini ve sütte meydana gelen değşiiklikleri (litmusun renginin açılması veya koyulaşması, sütün pıhtılaşması, vs.) incelemek amacıyla yapılır. Süt içerdiği maddeler (protein, laktoz, mineral maddeler, vitaminler, yağ, vs.) nedeniyle çok iyi besleyici bir ortam olduğu gibi, mikroorganizmaları da üretici bir niteliğe sahiptir. Bakteriler ürerken laktozu ayrıştırarak oluşturdukları organik asitler nedeniyle pH'nin düşmesine ve bunun sonucu litmus'un renginin acılmasına neden olurlar. Asit ortam aynı zamanda süt proteini olan kazeinin pıhtılaşmasına da yol açar. Laktozun ayrışma ürünleri arasında meydana gelen gazlar da, süt pıhtısının parçalanmasına sebep olurlar. Meydana gelebilecek değişiklikleri kolay görebilmek için süte katılan litmus (veya brom kresol purpul, klorfenol kırmızısı, metilen mavisi) nötral pH da leylak kırmızısı rengindedir. Asit ortamda açık pembe ve alkalide de mavi bir renk alır. Litmus aynı zamanda, sütteki, oksidasyon ve redüksiyon için de bir indikatördür. Redüksiyon, sütün renginin açılmasını (beyazımsı) sağlar. Süt pıhtılaşınca, üst kısmında sarımsı bir sıvı oluşur (süt serumu). Pıhtı sonradan peptonize olur ve eriyebilir.Materyal 1) İçinde litmus bulunan sütlü besi
yerleri Metot İndikatörlü süte mikroorganizma ekildikten sonra 37 °C de 1-7 gün inkübe edilir. Her gün oluşan değişikliklere dikkat edilir. Değerlendirme 1) Sütle laktozun ayrışması sonu asit
meydana gelmesi, Litmus'un renginin pembeleşmesine ve aynı zamanda sütün
pıhtılaşmasına neden olur. Dikkat edilecek noktalar 1) Bu test, mikroorganizmaların identifikasyonlarında ikinci derecede
kullanılır. 02.19. Malonat testi Bu test, mikroorganizmaların besi yerlerine konan malonat'tan karbon kaynağı olarak yararlanabilme yeteneğini ölçmede kullanılır. Mikroorganizma cinslerini ( Arizona (+), Salmonella (-), Klebsiella ve Enterobacter (+), E. coli (+) ayırmada işe yarar.Materyal 1) Sodyum malonat buyyonu (açık yeşil renkte, pH 6.7, tüpte 5 ml) Metot Kültürlerden buyyonlara ekim yapıldıktan sonra 37°C de 2-3 gün inkube edilir. Tüpler her gün gözle kontrol edilir. Değerlendirme Mikroorganizma tarafından malonatın kullanıldığı durumlada ortamın pH'sı 7.6 yükselebilir. Böyle alkali ortamda Prusya mavisi renk ortaya çıkar (pozitif reaksiyon). Herhangi bir reaksiyonun olmadığı durumlada, besi yerinin orijinal rengi (açık yeşil) muhafaza edilir (negatif reaksiyon). Glikozun fermentasyonu durumu nda sarı renk meydana gelir (pH 6.0).Dikkat edilecek noktalar 1) Bazı malonat pozitif mikroorganizmalar hafif alkali
oluşturabilirler. Bunları değerlendirmede güçlük çekilir. Bu zaman inokule
edilmemiş tüplerle kontrol edilir. Hafif mavilikte olsa pozitif olarak değerlendirilir. 02.20. Metil Kırmızısı Testi Bu test, glikozun fermentatif metobolize olması sonu besi yerinde organik asitlerin meydana glediğini ve pH'nın düştüğünü ortaya koymak için yapılır. Deney, mikroorganizma cinslerinin ( E. coli +, Enterobacter aerogenes -, E. cloacae -) ve türleri (L. monocytogenes +) ayırmada kullanılır. Metil kırmızısı solusyonu pH 6.0 da sarı renk ve pH 4.4 den aşağıda kırmızı renk gösterir.
Materyal 1) Tüpte hazırlanmış Clark ve Lubs besi yeri (MR/VP buyyonu) Metot Üremiş kültürlerden, besi yerlerine ekimler yapılır ve tüpler 37 °C de 2-7 gün inkubasyona bırakılır. Üzerine metil kırmızısı solusyonunundan 4-5 damla damlatılır ve iyice karıştırılır. Değerlendirme Metil red, besi yerine damlatıldıktan sonra üstte kırmızı renkli bir halkanın meydana gelişi pozitif metil kırmızısı testi olarak kabul edilir. Negatif reaksion halinde üst tarafta sarı bir halka görülür. Dikkat edilecek noktalar 1) Kültürlerin yeterince inkubasyonda kaldıktan sonra test
uygulanmalıdır. 02.21. Niasin Testi Bu test, insan tipi tuberküloz etkenini (M. tuberculosis) ayırmada kullanılır. Bu etken kültürlerde ürediği zaman niasin (nikotinik asit) sentezler. Deney, bu maddeyi ortaya koymak için uygulanır. Materyal 1) Renksiz tuberküloz besi yeri (Dubos, Dorset, vs.) Metot Tuberküloz mikroorganizması ( M. tuberculosis) adı geçen besi yerlerine ekilerek 37°C de 2-3 hafta inkube edilir. İyi bir üremenin meydana gelmesi sağlanır. Kültürlerden yeteri miktarda alınarak tüpte suspansiyon yapılır ve iyice karıştırılır. Tüpe önce % 4 lük etanollu anilin'den 0.6 ml. konur ve sonra da 0.6 ml. % 10 luk siyonojen bromid ilave edilir.Değerlendirme Tüp içinde sarı rengin meydana gelmesi niasin'in varlığını ifade eder (pozitif reaksiyon). Dikkat edilecek noktalar 1) Siyanojen bromid toksiktir. Kullanırken dikkat edilmelidir.Test bittikten sonra tüpe alkali (10 N NaOH) katılarak (veya % 10 amonyak) ayıraç detoksifiye edili r.2) Test, bir steril kabinet içinde uygulanmalıdır. 3) Bazı kromojenik mikobakteriler testte sarı renk meydana getirebilirler. 02.22. Nişasta Hidrolizasyon Testi
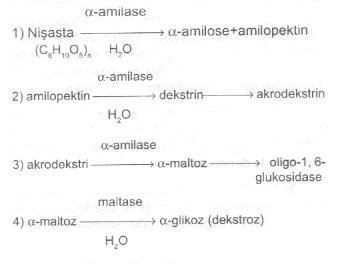
Materyal 1) Petri kutularında hazırlanmış
nişastalı agar besi yerleri Metot Nişasta hidrolizasyon aktivitesi ölçülecek mikroorganizmadan nişastalı agar üzerine çizgi tarzında ekimler yapılır ve 37°C de 2-5 gün inkube edilirler. Diğer bir besi yeri de iki kısma ayrılarak her bir yarımına kontrol mikroorganizmalar ekilir. Değerlendirme 1) İnkubasyon süresinin sonunda agarların üzeri lugol solusyonu ile
kaplanır. Pozitif reaksiyonlarda, koloni etrafında renksiz bir halka oluşur (alfa-amilase
enziminin nişastayı hidrolizasyonu sonu). Negatif durumlarda besi yeri mavi renkte
görülür. Koloni etrafındaki oluşan pembe-esmer bölge şüpheli reaksiyonu ifade
eder. Reaksiyon 5 dakika içinde okunmalıdır. Dikkat edilecek noktalar: 1) Nişastalı katı veya sıvı besi yerleri çok fazla
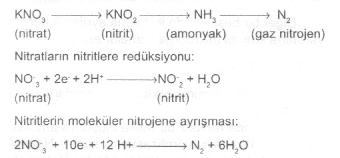
ısıtılmamalıdır. 02.23. Nitrat Redüksiyon Testi Bu test, mikroorganizmaların nitratları redükte edebilme yeteneğini belirlemede kullanılır.
Test, mikropların türlerini ayırt etmede büyük yardımcı olur. Enterobacteriaceae familyası genellikle pozitif reaksiyon verir. Nitratların ayrışması sonu oluşan ürünler mikropların karakterine göre değişebilir. Her ne kadar gaz nitrojen meydana gelirse de bunun yanı sıra nitrik oksidi (NO) ve nitrös oksid (N 2O) veya hidroksilamin (R.NH.OH) de teşekkül edebilir. Bu maddeler hücre içinde metabolize edilerek protein ve nukleik asit yapımında yapıtaşı olarak kullanılırlar.Materyal 1) İçinde Durham tüpleri bulunan nitratlı (KNO 3, % 0.1) sıvı besi yerleri (pH 7.0, 5 ml) gerektiğinde yarı katı besi yeri.2) Mikroorganizmaların saf ve taze kültürleri 3) Kontrol pozitif (S. gallinarum) ve negatif (H. vaginalis, veya Acinetobacter anitratus) kültürleri. 4) Griess-Ilosvay ayıracı (taze hazırlanmış) (alfa naftilamin % 0.5 (A) + sulfanilik asit %0.8 (B)). 5) Ekilmemiş sıvı besi yerleri. Metot Üremiş mikroorganizmalarından nitratlı sıvı besi yerlerine ekim yapıldıktan sonra tüpleri 37°C de 1-5 gün inkubasyona bırakılır. Durham tüpleri içinde gazın oluşumuna dikkat edilir. Tüplere Griess-IIlosvay ayıraçlarından (A+B) 5'er damla konur. Değerlendirme 1) Tüplerde gaz oluşumu (N 2) denitrifikasyonu gösterir ve pozitif olarak kabul edilebilir (eğer bakteriler fermenter değilse). Ancak, böyle tüplere Griess-Illosvay ayıracından A ve B solusyonlarından 5'er damla damlatıldıktan sonra hafifçe çalkalanır. Bir iki dakika içinde kırmızı rengin meydana gelmesi de nitratların nitritlere kadar redükte olduğunu ifade eder (pozitif reaksiyon).2) Tüplerde gaz yoksa, yine ayıraç damlatılır. Bir iki dakika içinde kırmızı rengin meydana gelmesi pozitif olarak kabul edilir. 3) Eğer, sonuç negatif (hiç reaksiyon oluşmazsa) olarak görülürse, ya nitratlar hiç ayrışmamıştır veya nitratların ayrışması nitrit safhasından da öteye (amonyak veya gaz nitrojene ulaşmış olabilir. Bu durumda, ayıraçlar konmuş olan tüplere çok az miktarda toz çinko (15-20 mg) katılır. Eğer, çinko ilavesi sonu kırmızı renk meydana gelirse (nitrat nitrite redükte olmuştur). Sonuç negatif olarak değerlendirilir. Eğer kırmızı renk oluşmazsa, bu durum, nitratların nitritden de daha öteki safhalara redükte olduğunu ifade eder (pozitif reaksiyon). Amonyak oluşumu de Nessler ayıracı ile ortaya konabilir. Dikkat edilecek noktalar 1) Bazı mikroorganizmalar fermentasyon sonu tüpler içinde gaz (hidrojen) meydana getirebilir. Bu durum karşısında bakterinin karakterini iyi bilmek gerekir. Eğer tüpte gaz oluşmuşsa ve mikroorganizma fermentasyon oluşturan türden değilse, gazın nitrojen (N 2) olma olasılığı büyüktür ve ayıracı koymaya gerek olmayabilir. Ancak, bakteri fermenter türden ise ayıraçları kullanmak zorunludur.2) Bazı araştırıcılar ayrı katı ortamların daha iyi sonuç verdiğini bildirmektedirler. Gerekirse içinde % 0.02 - 0.04 agar ve % 0.1 KNO3 bulunan yarı katı besiyeri de denenebilir. 3) Ayıraçlar taze hazırlanmaları ve iyi çalıştıkları kontrol edilmelidir. A-reagenti buzdolabında ve buna karşın b-reagenti ise oda sıcaklığında muhafaza edilmelidir. 4) Alfa naftil amin karsinojenik etkiye sahip olduğundan dikkatlice kullanılmalıdır (pamuklu pipetle ve ağızdan çekilerek kullanılmaz). 02.24. Oksidasyon ve/veya Fermentasyon (O/F) Testi Bu test, mikroorganizmaların karbonhidratları (özellikle, glikozu) ayrıştırmada oksidatif veya fermentatif metabolik yolu kullanma durumlarını saptamada işe yarar ve ayrıca bakterilerin identifikasyonununda da yararlanılır. Bazı mikroorganizmalar glikozu oksidatif karakterde metabolize ederler. Aerobik koşullarda meydana gelen bu reaksiyonda, oksijen, son hidrojen alıcısı olarak görev yapar. Buna karşın, bir kısım bakteriler de, glikozu, oksijenin olmadığı duruml arda ayrıştırma yeteneklerine sahiptirler (fermentasyon). Bu reaksiyon anaerobik şartlarda gelişir ve hidrojen alıcısı olarak oksijenden başka diğer substanslar kullanılır.Materyal 1) Tüpte hazırlanmış (4-5 ml) dik Hugh ve Leifson besi yerinden 2
(veya gereği kadar) tane Metot Taze kültüre batırılmış steril iğne her iki besi yerine dikine daldırılmak suretiyle ekilir. Bir tanesine (fermentasyon için) 1 cm kalınlıkta olacak tarzda sıvı steril parafin ilave edilir. Tüplerin ağzı iyice kapatılır ve 37 °C de 1-15 gün kadar inkübasyonda tutulur ve her gün kontrol edilir. Değerlendirme 1) Oksidatif karakterde glikozun ayrışması sadece parafinsiz tüpte
(açık tüp) görülür. Besiyerinin orijinal rengi (mavi-yeşil) sarıya döner. Bu renk
değişimi oksidasyon pozitif olarak değerlendirilir. Üstü kapalı diğer tüpte bir
değişiklik yoktur. Dikkat edilecek noktalar 1) Bazı araştırıcılar, kullanmadan önce besi yerlerini ısıtarak
(su banyosunda), içindeki erimiş havanın çıkmasını sağlarlar. Hemen soğutularak
ekim yapılır. 02.25. Oksidase Testi Bu test, mikroorganizmalar tarafından sentezlenen ve intrasellüler olan oksidase enziminin (sitokrom C oksidase) varlığını ortaya koymada kullanılır. Deneyden aynı zamanda cinslerin (Moraxella (+), Neisseria (+), Yersinia (-), Acinetobacter (-), ve türlerin (B. ovis (-), B.neotomae (-) ve B. abortus ( + ) ayırımında yararlanılır. Oksidase reaksiyonu, bakterilerde (aerobik olanlarda) sitokrom oksidase sisteminin bulunduğunu ifade eder.
Yukarıda da görüldüğü gibi (2. basamak) okside olmuş sitokrom C, ayıraçta bulunan p-amino dimetilanilini okside ederek, renkli bileşik oluşturur (kırmızı - mavi renk). Materyal 1) Petri kutusunda veya tüplerde katı besi yeri (sıvı besi yeri de
kullanılabilir). Metot Mikroorganizmalar katı besi yerine ekildikten sonra 37 °C de 1-5 gün inkubasyona bırakılır. Üremiş koloniler üzerine ayıraç damlatılır. Değerlendirme Üzerine ayıraç damlatılan kolonilerin 1-2 dakika içinde kırmızı mavi renk almaları pozitif oksidase testi olarak kabul edilir. Hiç bir renk değişikliğinin olmaması negatif olarak değerlendirilir. Kolonilerin siyah renk alması öldüklerini ifade eder. Dikkat edilecek noktalar 1) Ayıraç sadece kolonilerin üzerine damlatılır. Bütün plate
veya tüpe yayılmaz. 02.26. Potasyum Siyanid Testi Bu test, mikroorganizmaların potasyum siyanid (KNC) içeren besi yerlerinde canlı kalma ve üreyebilme durumlarını belirlemek için kullanılır. Aynı zamanda testten, mikroorganizma cins ( Citrobacter freundii (+), Salmonella (-), Arizona (-) Klebsiella (-), Enterobacter (+) ve E. coli (-) ve türleri (P. aeruginosa (+) ve Alcaligenes faecalis (-) ayırmada da işe yarar. Siyanid (CN) , bir sitokromoksidase inhibitörüdür. Demir içeren enzimler siyanid tarafından bloke edilirler. Siyanid demirle birleşerek enzimi inaktive eder. Sitokrom oksidase de ağır metalli bir pigment olup (ferro sitokrom oksidase) siyanidle birleşerek elektron transport mekanizmasını sekteye uğratır ve respirasyon durur. Oluşan inhibisyonun derecesi siyanidin miktarı ile ilgilidir. Bazı mikroplar, ortamda 0.001 M siyanid bulununca üremezler.Materyal 1) İçinde potasyum siyanid (1/13000 KCN) bulunan sıvı ortam ( pH
7.6 ve 1 ml). Metot Kültürlerden siyanidli brotha ekim yapılır ve 37 °C de 1-3 inkube edilir. Değerlendirme Pozitif olgularda tüpte üreme yoktur. Negatif durumlarda üreme meydana gelir. Sonuçlar kontrollerle karşılaştırılarak değerlendirilir. Dikkat edilecek noktalar 1) KCN çok zehirli olduğu için, bu teste çok gerekli olduğu zaman
başvurulmalıdır. KCN solusyonu, pipetle ağız yardımıyla çekilmemelidir. KNC
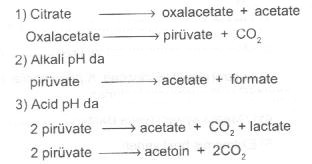
dumanları da teneffüs edilmemelidir. Şırıngadan yararlanılır. 02.27. Sitrat Testi Bu test, mikroorganizmaların, besi yerlerine katılan sitratı karbon kaynağı ve amonyum tuzlarını da nitrojen kaynağı olarak kullanabilme yeteneğini saptamada, bakteri cins ve türlerini identifikasyonda kullanılır. Bakteriler tarafından sitratın ayrışması (sitrat metabolizması) enzim sistemi tarafından gerçekleştirilir. Bu enz ime citritase (citrate oxalacetate-lyase) veya citrate demolase adı verilir.
Yukarıda da görüldüğü gibi alkali pH da (No.2), daha fazla acetate ve formate meydana gelmesine karşın, asit ortamda (No.3) acetylmethylcarbinol (acetoin) ve lactatelar esas ününler arasında bulunmaktadır. Sitrat fermentasyonu için kullanılan besi yerlerinde amonyum tuzlarının bulunması nedeniyle de, bakterilerin bu tuzu nitroje n kaynağı olarak kullanabilme yetenekleri de ölçülmektedir. Amonyum tuzu ayrışınca amonyak (NH3) meydana gelerek ortamın pH sı yükselir. Bakteriler tarafından organik asit ve tuzlarının karbon kaynağı olarak kullanılması sonucu karbonatlar ve bikarbonatlar meydana gelir.Materyal 1) Tüp içinde yatık Simmons citrate agar besi yeri (4-5 ml, pH 6.9
ve yeşil renkte) veya Christensen sitrat sulfid besi yeri (4-5 ml pH 6.7, açık renkte) Metot Muayeneleri yapılacak saf kültürler steril fizyolojik su veya buffer ile biraz sulandırıldıktan sonra besi yerlerine ekimler yapılır ve tüpler 2-7 gün 37 °C inkubasyonda tutulur. Christensen besi yerine iğne ile inokulasyon yapılır ve yatık yüzeye de iğne sürülür. Değerlendirme 1) Simmons citrate besi yerinde, uygun bir inkubasyon süresi sonunda
hiçbir üremenin olmaması ve ortamın orijinal yeşil rengini muhafazası negatif
reaksiyon ve ekim hattı boyunca üreme ile birlikte koyu mavi rengin meydana gelmesi de
pozitif reaksiyon olarak değerlendirilir. Dikkat edilecek noktalar 1) Besi yerleri taze hazırlanmalı, buzdolabında muhafaza edilmeli,
orijinal rengini kaybedenler teste konulmamalıdır. 02.28. Ürease Testi Bu test, mikroorganizmaların üreyi hidrolize eden ürease enzimini saptamak amacıyla yapılır. Ürease hidrolizasyon testi bakterilerin cins ve türlerini tayinde işe yarar. Üre, karbonik asitin bir diamididir. Bütün amidler de kolayca hidrolize olurlar. Ürenin hidrolizasyonu da spesifik bir enzim olan ürease tarafından katalize edilir. Reaksiyonun sonunda 2 molekül amonyak ve karbondioksid meydana gelir.
Ürease aktivitesi için optimal pH 7.0 dir. Besiyerinde amonyak meydana gelmesi pH nın yükselmesine neden olur. Amonyağın meydana geldiği de indikatör boya ve Nessler ayıracı ile ortaya konur. Ürease testi için bazı yöntemler (Christensen, Stuart, vs.) geliştirilmiştir. Bunların seçimi araştırıcıya bağlıdır. Aşağıda Christensen Metodu bildirilmiştir. Materyal 1) Christensen'in üreli agarı (tüp veya petri kutusunda) veya üreli
broth Metot Petri kutusu üzerine fazla miktarda mikroorganizma ekildikten sonra 37°C de 1-5 gün bırakılır. Her gün kontrol edilen kültürlerde (kırmızı rengin meydana gelmesi pozitif reaksiyon) renk değişmelerine dikkat edilir. Bazı durumlarda renk değişikliği 5-6 saat içinde meydana gelebilir. Değerlendirme Kültürde kırmızı rengin meydana gelmesi (amonyak oluşumu nedeniyle pH'nın yükselmesi sonu indikatörün renginin ortaya çıkması) pozitif reaksiyon olarak ve hiçbir değişikliğin olmaması de negatif olarak değerlendirilir. 02.29. Voges - Proskauer (VP) Testi Bu test, bazı mikroorganizmaların glikozu fermente edilerek, nötral bir ürün olan acetylmethylcarbinol'u (acetoin) meydana getirme yeteneğini tayinde kullanılır. Bakteri türlerini ( K. pneumoniae (+), E. coli (-) belirlemede kullanılır. Glikoz, önce pirüvik asit'e metabolize olur. Pirüvik asit, glikolizisde en önemli kilit intermedierdir. Pirüvik asidin ayrışması, bakterilerin türlerine göre aerobik veya anaerobik yolla olur. Glikozun fermentasyonu sonu acetoin ve bunun bir nötral redüksiyon ürünü olan 2,3 -butanediol'da (CH3.CHOH.CH3) meydana gelmektedir.Voges Proskauer testi ile metil red testi, ortamlarının aynı olması nedeniyle birlikte uygulanabilirler. Metil red pozitif olanlarda (organik asit fazla olması nedeniyle), VP reaksiyonu negatif olabilir. Nötral ürünler meydana gelmeyebilir (genel bir kural değil). İlk başlangıçta MR testi pozitif görülebilir. İnkubasyon süresi uzarsa acetoin oluşabilir. Materyal 1) MR/VP besi yeri (Clark-Lubs, pH 6.9,5 ml) Metot İçinde glikoz bulunan bufferlı besi yerine kültürlerden ekilir ve 37°C de 2-7 gün inkube edilir. Bu sürenin sonunda kültürlere ve ekilmemiş tüplere ayıraçtan (O'Meara) 1 ml ilave edilerek hafifçe çalkalanır ve su banyosunda (37°C de) 4 saat tutulur. Aralıklı olarak hafifçe çalkalanır. Değerlendirme Besiyerinin üstünde 2-5 dakika içinde pembe rengin oluşu, acetoin varlığını ortaya koyduğundan pozitif reaksiyon olarak kabul edilir. Eğer sarı renk meydana gelirse negatif olarak dikkate alınır.O'Meara testi, ortamda oluşan acetoin'e bağlıdır. Bu madde de, oksijenin bulunduğu durumda alkali ortamda okside olur ve diasetil (CH3.CO.CO.CO3) meydana gelir. Bu son madde de, kreatin'le reaksiyona girerek pembe renk meydana getirir. Dikkat edilecek noktalar 1) Ayıraçlar kullanılmadan önce iyice kontrol edilmelidirler.
1 Kaynak: Temel Mikrobiyoloji |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||